1. 引言
胃癌是全球第五大常见的癌症,死亡率高居世界第四 [1] 。虽然早期胃癌的五年生存率高达90%以上,但由于早期诊断率低,多数患者发现时已至晚期 [2] 。随着治疗手段的多样化,晚期胃癌的预后已得到明显改善,单纯的手术治疗已不是唯一选择。腹腔镜和机器人技术揭开了胃癌治疗的新序幕;放化疗拓宽了胃癌治疗的新方向;靶向和免疫治疗开启了胃癌治疗的新模式 [3] [4] 。但关于其实施和应用依然存在诸多争议和质疑,现结合本院一例新辅助化疗联合腹腔镜根治性胃切除术治疗局部晚期胃癌患者的诊疗过程,分享新辅助化疗联合腹腔镜手术根治性治疗局部晚期胃癌的成功经验。
2. 一般资料
患者男,45岁,2020年11月因“上腹部不适1月余”入院,患者伴有反酸嗳气,饭后加重,偶有恶心呕吐,有黑便,大便干结等症状。5月前于当地医院行电子胃镜检查发现胃窦巨大隆起溃疡肿物,病理示胃腺癌,为求进一步治疗来我院就诊。否认糖尿病、高血压、冠心病病史,否认输血、手术及外伤史,无药物过敏史,体重近1月下降约10 kg。
3. 检查
电子胃镜检查发现胃窦巨大隆起溃疡肿物,覆污秽苔,可见血痂,幽门口狭窄。病理显示胃恶性肿瘤(cT4b?N1-2?Mx腺癌);幽门梗阻(不全型)。腹部CT显示胃中下部胃壁不规则增厚,流出道可以见造影剂通过,胃周可见小肿大淋巴结影。
4. 诊断
2020年11月23日于我院行MDT多学科会诊,初步诊断为胃恶性肿瘤(cT4b?N1-2?Mx腺癌);幽门梗阻(不全型)。综合考虑,局部肿块较大且与肝左叶关系密切,胃周多发淋巴结肿大,分期较晚,建议行术前新辅助化疗。
5. 治疗
患者分别于2020年11月27日、2020年12月18日、2021年1月9日行新辅助化疗。前3周期选择FLOT化疗方案,白蛋白紫杉醇200 mgdl,5 + 顺铂60 mgdl,并于第2、3周期配合赫赛汀480 mg治疗。连续化疗3周期后,复查胃镜和全腹部CT平扫 + 增强,内镜下见胃窦部有一不规则溃疡,底部不平整,边缘不规则堤样隆起,周边黏膜粗糙不平,活检质脆。活检病理提示胃窦腺癌(中分化),HP(-)。于2021年2月8日行第二次MDT,患者症状明显改善,上腹胀消失,无腹痛,无恶心呕吐。化疗后CT显示胃肿瘤有缩小表现,并与左肝内侧叶侵犯较前减轻。综合考虑,目前无消化道梗阻,肿瘤有降期表现,建议继续行新辅助治疗(赫赛汀 + FLOT) 2周期,动态评估疗效。化疗5周期后,复查胃镜和全腹部CT平扫 + 增强,内镜下见胃窦部黏膜粗糙水肿,红白相间,以白为主,黏膜下血管透见,胃窦前壁见一不规则溃疡,底部不平整,边缘不规则堤样隆起。活检病理提示胃窦前壁大部分为增生的肉芽组织及炎性渗出物,局灶见少许黏膜组织伴多量中性粒细胞浸润,部分腺体增生较著,细胞伴退变。2021年3月29日行第三次MDT,患者自述症状明显改善,腹部CT示胃窦部肿瘤较前明显缩小。化疗期间肿瘤标志物检查显示,患者肿瘤学指标CEA、CA19-9以及CA72-4随着化疗的进行逐渐降低至正常。患者自述化疗后症状减轻,上腹饱胀感及黑便消失,体力改善,精神状况良好,食欲及睡眠可,大小便正常,体重自化疗结束至今增加约10 kg。
患者于2021年4月21日行腹腔镜下根治性远端胃次全切除术(D2, Roux-en-Y),术中探查见肿瘤位于胃窦,大小约6 × 7 cm,浸透浆膜,表面可见钙化及粘液成分,周围淋巴结肿大明显。出血量约50 ml,术中无输血。
6. 治疗结果及转归
术后大标本病理:胃窦部中分化腺癌(溃疡型,范围6.5 × 4 cm,Laurens分型:肠型),侵达肌层,于粘膜下、肌层、浆膜下及浆膜见多灶粘液湖残留并钙化,部分区域肉芽组织增生,局灶见胆固醇结晶裂隙形成并多核巨细胞反应,肿瘤明显退缩(肿瘤退缩分级:TRG 2级)。
病理学分期:ypT2N0MX。免疫组化结果:EGFR (+),HER2 (1+),AFP (−),MLH1 (+),MSH2 (+),MSH6 (+),PMS2 (+),PD-L1 (22C3) (+),CPS约为10,S100示神经侵犯(−),CD31及D2-40示间质脉管癌栓(−),Ki-67 (+,约80%),EBER (原位杂交) (−)。特殊染色结果:弹力纤维染色示厚壁血管侵犯(−)。
7. 讨论
近年来,胃癌手术由传统的开放式胃切除术逐渐向微创手术转变。目前,局部晚期胃癌患者仍以腹腔镜胃切除术治疗为主,辅之以化疗和放疗 [5] 。现有证据表明,对于局部晚期胃癌患者,与开放胃切除术相比,腹腔镜辅助胃切除术的术后恢复更快 [6] 。随着对恶性肿瘤的深入研究,胃癌的治疗模式从单一的手术切除转变为围手术期治疗合并手术的新治疗模式,新辅助化疗作为一种治疗晚期胃癌的综合性方案逐渐受到关注 [7] 。自从MAGIC (医学研究委员会辅助胃灌注化疗)试验以来,胃癌的新辅助化疗已经被广泛接受,因其具有更好的耐受性、肿瘤降期以及消除隐匿性转移等优势,大大提高了根治性切除和治愈胃癌的机会 [8] [9] [10] 。有研究显示,新辅助化疗联合腹腔镜辅助胃癌根治术治疗可提高胃癌患者的疾病控制率和近期临床疗效,并可增加进展期胃癌患者根治性切除的机会 [11] 。
根据临床研究报道,胃癌术前化疗可缩小肿瘤的体积,降低原发肿瘤分期,清扫隐藏的微小转移灶,提高手术切除成功率,从而减少术后的复发率和死亡率,改善患者预后 [8] [12] [13] 。Cho等 [14] 回顾了22例经新辅助化疗后病理完全缓解的晚期胃癌患者,虽然12例患者(54.5%)未接受术后化疗,但术后5年生存率高达85%。有研究显示,术前行新辅助化疗比术后化疗的效果更为显著 [12] [15] 。
本病例在新辅助化疗前诊断为胃腺癌(cT4b?N1-2?Mx),根据中国抗癌协会胃癌专业委员会2021年发布的《局部晚期胃癌围手术期治疗中国专家共识》 [16] 推荐使用新辅助化疗。首次住院后完善各项检查,经过MDT多学科会议讨论后考虑胃窦部肿块较大且与肝左叶关系密切,胃周多发淋巴结肿大,建议行术前给予FLOT新辅助化疗,动态评估疗效,待肿瘤降期或退缩后再行根治手术切除治疗。该病例经5个周期新辅助化疗复查胃镜前后对比发现,内镜下肿瘤体积明显减小,管腔阻塞明显改善(图1),全腹部CT + 增强扫描同样发现原灶区明显降期,周围未见明显肿大的淋巴结(图2)。从影像学角度得出肿瘤退缩明显,可进行手术切除。指南推荐术前新辅助化疗4~6周期后评估其疗效,该病例在术前新辅助化疗5个周期后,无论从患者的症状(图3)、影像学及内镜检查还是肿瘤标志物水平(表1)上均可见明显改善。
有研究指出,新辅助化疗可能会增加术后并发症的发生,其发生率约为20% [17] 。化疗药物可能会导致胃周围形成瘢痕组织,从而增加手术切除的难度;化疗还可能引起患者感染或全身情况恶化,给手术和术后恢复增加了难度;此外,有效的化疗会导致肿瘤体积缩小,使外科医生难以确定手术切除的范围 [7] 。因此,目前普遍认为在新辅助化疗后,手术切除的范围必须根据化疗前肿瘤的位置和大
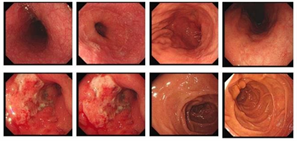
 化疗3周期后胃镜 化疗5周期后胃镜
化疗3周期后胃镜 化疗5周期后胃镜
Figure 1. Gastroscope significant reductions in tumor volume and improvement in lumen obstruction
图1. 胃镜肿瘤体积明显减小,管腔阻塞明显改善

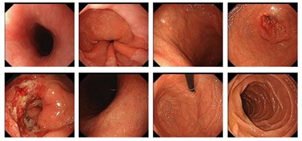
 化疗3周期后CT 化疗5周期后CT
化疗3周期后CT 化疗5周期后CT
Figure 2. Abdominal CT + enhanced scanning significant reductions in gastric antral tumors after chemotherapy
图2. 腹部CT + 增强扫描化疗后胃窦部肿瘤明显缩小

Table 1. Changes in tumor markers
表1. 肿瘤标志物变化情况
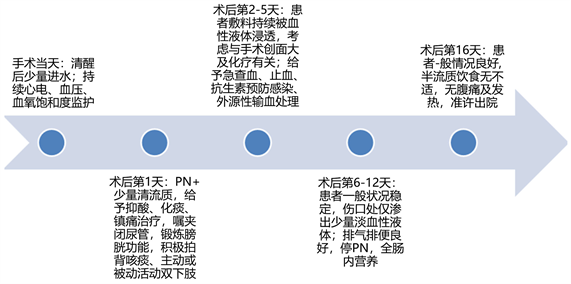
Figure 3. Timeline of postoperative recovery
图3. 术后恢复时间轴
小来确定 [18] 。在本病例中,患者术后第2天出现明显的出血,考虑为手术创面及化疗所致,经过积极的止血、抗感染和输血处理后,术后第6天出血量显著减少,生命体征平稳。新辅助化疗联合腹腔镜辅助胃癌根治术对该病例的治疗效果较好,未发生严重并发症,但此结果仍需扩大样本量来进一步验证。
总之,目前的证据表明新辅助化疗治疗局部晚期胃癌的疗效及预后较好,在新辅助化疗实现肿瘤退缩后及时进行外科手术切除毋庸置疑,以使患者有更长的无瘤生存期及总生存期 [19] 。手术切除仍是晚期胃癌治疗的最佳手段,在追求化疗的同时要认准时间窗以免延误手术切除的时机。此外,新辅助化疗的药物选择是一个动态过程,目前尚无金标准可言 [20] [21] 。新辅助化疗后腹腔镜手术的安全性和有效性仍不清楚,在实际的临床实践中,更小的创伤面积是否等同于更佳的术后安全性、化疗完成度以及更高的生存获益仍然是一个关键问题。因此,需要继续研究以确定局部晚期胃癌患者的最佳治疗方法。
NOTES
*通讯作者Email: heyue1116@163.com