1. 引言
经过多年的研究发现,一些水杨醛类席夫碱及配合物不仅具有良好的杀菌、止痛、抗炎及抗病毒等作用外 [1] [2] [3] [4] ,还具有一些抗癌活性 [5] [6] [7] [8] ;在分析化学方面,许多席夫碱已经被用于各种金属离子的分析检测和金属鉴定;特别是在金属腐蚀领域,某些含有C = N双键和含−OH的芳香族化合物容易与金属形成稳定的金属络合物,从而有效防止对金属腐蚀。正因为水杨醛类席夫碱化合物及其配合物在化学、生物医药、分析、金属腐蚀、催化等领域一直备受广泛关注 [9] [10] ,为了找到具有更好生物活性的水杨醛类席夫碱化合物,本文以2-羟基苯甲醛,2-羟基-4-甲氧基苯甲醛两种物质为原料,乙醇作为溶剂,在一定的温度下,与2-甲氧基苯基乙胺反应,通过缩合反应制得两种席夫碱配体。然后,席夫碱配体与四水合乙酸镍反应制得金属配合物,并将继续研究这两种配合物的生物活性,以便找到更好的抗肿瘤靶向药物。
2. 实验部分
2.1. 实验试剂
主要实验药品:邻羟基苯甲醛、2-羟基-4-甲氧基苯甲醛、2-甲氧基苯基乙胺、四水合乙酸镍、无水乙醇(分析纯);二甲亚砜(DMSO) (化学纯)。
主要仪器:电子分析天平:AUY-120北京泰克仪器有限公司;数字显示显微熔点测定仪:X-4北京泰克仪器有限公司;紫外可见分光光度计:UV-2300北京普析通用仪器有限公司;傅立叶型红外光谱仪:FTIR-650天津港东;核磁共振波谱仪:AV600MHz德国Bruker公司;热重分析仪:TG 209 F3德国NETZSCH公司。
2.2. 合成路线
席夫碱配体及席夫碱镍配合物的合成路线如下图所示(见图1)。
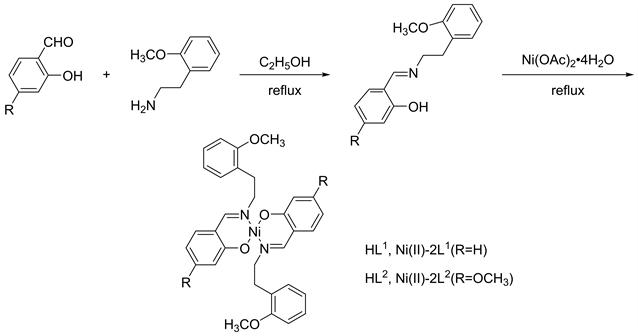
Figure 1. Synthesis route of the target compound
图1. 目标化合物的合成路线
2.3. 实验步骤
2.3.1. 席夫碱配体(HL1)的合成
将2-甲氧基苯基乙胺(1 mmol)和2-羟基苯甲醛(1 mmol)溶解在无水乙醇(16 mL)中,在45~50℃的热水浴中搅拌使溶液迅速混合均匀,回流3 h,反应完全后冷却到室温。然后抽滤,洗涤,干燥得到黄色固体HL1。产率50%,熔点64℃。
2.3.2. 席夫碱镍配合物(Ni(II)2L1)的合成
将乙酸镍(0.5 mmol)溶解在20 mL的乙醇溶液中,加入HL1配体,回流4小时;然后冷却,抽滤得到绿色固体Ni(Ⅱ)2L1,产率30%,熔点163℃。
2.3.3. 席夫碱配体(HL2)的合成
将2-甲氧基苯基乙胺(1 mmol)和2-羟基-4-甲氧基苯甲醛(1 mmol)混合溶解在无水乙醇(16 mL)中,在45~50℃的热水浴中搅拌使溶液混合均匀,回流3 h,充分反应后停止加热,冷却,抽滤、干燥得到黄色固体HL2。产率60%,熔点78℃。
2.3.4. 席夫碱镍配合物(Ni(II)2L2)的合成
将乙酸镍(0.5 mmol)溶解在20 mL乙醇溶液中,加入HL2配体,立即观察到绿色沉淀,然后将其混合物回流4小时。冷却至室温,抽滤收集得到绿色固体Ni(Ⅱ)2 L2。产率40%,熔点199℃。
3. 结果与讨论
3.1. 席夫碱及其配合物的红外图谱解析
席夫碱及其配合物的红外光谱图如下图所示(见图2和图3)。
从图2和图3的红外光谱分析中对比得出如下结论。
从图3中可以看出配合物在波数为1610 cm−1的光谱中存在一个强带,是由于特征基团C = N键拉伸振动引起的,对比图2配体的红外图谱,可以看出金属配合物的C = N的伸缩振动峰比一般的C = N的红外吸收(1640~1690 cm−1)偏低一些,向低波方向移动,这说明席夫碱配体中C = N键与金属离子发生了配位;在图3中出现在580~660 cm−1附近的谱带可归因于Ni-O拉伸振动,说明酚羟基O参与了配位;在400~480 cm−1处较弱的吸收频率归因为Ni-N的拉伸振动,进一步说明了配体中C = N中的N原子参与了配位。
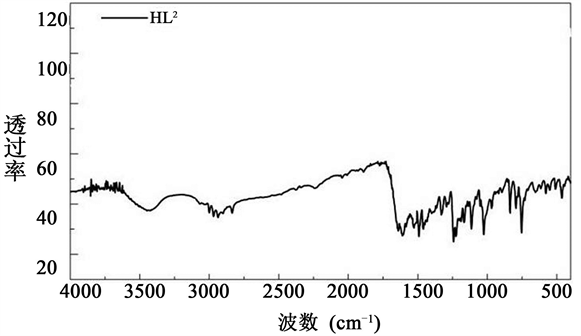
Figure 2. The FT-IR of the Schiff base ligands
图2. 席夫碱配体的红外光谱图
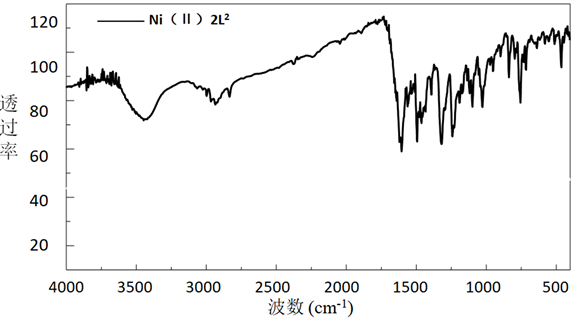
Figure 3. The FT-IR of the Schiff base complexes
图3. 席夫碱配合物的红外光光谱图
3.2. 席夫碱及其配合物的紫外图谱解析
席夫碱及其配合物的紫外光谱图如下图所示(见图4和图5)。
室温下使用紫外可见分光光度计测得席夫碱及其配合物的紫外光谱图。如图4~5所示,配体HL2的UV-vis光谱在302 nm和387 nm处显示两个强带,这些带可以指定为π − π*跃迁和C = N基团的n − π*跃迁。配合物Ni(II)-2L1在约616 nm和配合物Ni(II)-2L2在600 nm处观察到弱的吸收带,是由于d − d跃迁引起的。
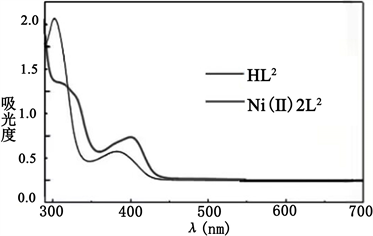
Figure 4. The UV spectrograms of the ligand HL1 and the complexes Ni(Ⅱ)2L2
图4. 配体HL2及配合物Ni(Ⅱ)2L2的紫外光谱图

Figure 5. The UV spectrograms of the complexes Ni (II)2L and Ni(Ⅱ)2L2
图5. 配合物Ni(II)2L1和Ni(II)2L2的紫外光谱图
3.3. 席夫碱及其配合物的核磁共振图谱解析
席夫碱及其配合物的核磁共振光谱图如下图所示(见图6和图7)。
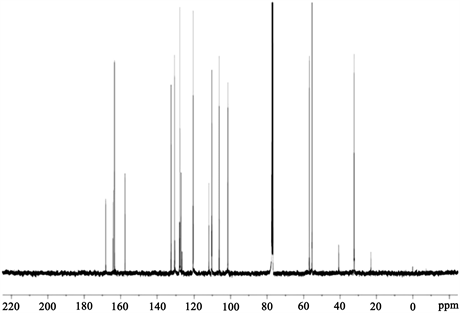
Figure 6. Carbon spectrogram of the Schiff base ligand HL2
图6. 席夫碱配体HL2的碳谱图

Figure 7. 1H NMR spectrogram of the Schiff base ligand HL2
图7. 席夫碱配体HL2的核磁共振氢谱图
席夫碱配体HL2的碳谱图如图6所示:
(1) 席夫碱配体在168.29 ppm处显示出亚甲氨基10号碳的碳峰;
(2) 1号和17号甲氧基上的碳峰分别在55.31 ppm和55.40 ppm处;
(3) 8号和9号碳的碳峰分别在32.26 ppm和56.81 ppm处;
(4) 苯环上的碳峰出现在100~140 ppm处。
希夫碱配体HL2的核磁共振氢谱图如图7所示:
(1) 在7.9 ppm处显示出清晰的单峰信号,是由于(−HC(10) = N−)引起的;
(2) 亚甲基(Ph-CH2(8) −)在3.7 ppm处发生共振;
(3) 亚甲基(N-CH2(9))在3 ppm处有明显的吸收信号;
(4) 在6.8~7.3 ppm处,峰面积为7,是苯环上的氢引起的;
(5) 在3.8 ppm处的吸收信号是由两个甲氧基上的氢引起的。
席夫碱及其配合物的核磁共振图谱解析如表1。

Table 1. 1H NMR and 13C NMR spectroscopic date of the Schiff base ligands and complexes
表1. 席夫碱配体及配合物的1H NMR和13C NMR光谱数据
4. 结论
以邻羟基苯甲醛、2-羟基-4-甲氧基苯甲醛为原料,乙醇为溶剂,在适当的温度下分别与2-甲氧基苯基乙胺反应,制得两种席夫碱配体HL1、HL2;由席夫碱配体与乙酸镍反应所制得相应的金属配合物,通过紫外光谱、红外光谱、氢谱、碳谱对席夫碱配体及配合物进行了表征,结果表明合成的两种席夫碱及其配合物的结构与理论相符合。
课题题目
一类新型水杨醛Schiff碱及过渡金属配合物的合成与生物活性研究(湖北省大学生创新创业训练计划项目,项目编号:S202110927041)。
参考文献
NOTES
*通讯作者。