1. 引言
哮喘是一种影响所有年龄段的气道慢性炎症性疾病 [1] ,主要症状是发作性的喘息、气急、胸闷以及咳嗽。根据联合国世界卫生组织的报道,世界范围内哮喘患者约达三亿之多,我国约有哮喘患者3千万,近年来我国哮喘发病率呈明显上升的趋势,并波及到不同年龄或不同经济状况的人群中 [2] [3] [4] 。支气管哮喘是由嗜酸性粒细胞、肥大细胞、T淋巴细胞、中性粒细胞、气道上皮细胞等细胞组分参与的气道慢性炎症性疾病。尽管涉及哮喘的病理生理机制仍有待阐明,但最常见的哮喘表型以Th2分泌的细胞因子(例如IL-4、IL-5和IL-13)的增加以及血清免疫球蛋白E (IgE)和嗜酸性粒细胞增多为主要特征 [5] [6] 。
目前,针对过敏性哮喘的有效的特异性治疗手段却相对甚少,例如以布地奈德为代表的激素治疗虽然有一定效果,但长期应用副作用比较大。大量的临床前研究证明,利用间充质干细胞治疗急性肺损伤和肺部感染性炎症疗效显著。然而,干细胞不仅有保存和运输方面的限制,还有致瘤风险的存在。
成体干细胞如MSCs由于扩增能力有限,其成瘤性风险也较低。但有注射胎儿神经干细胞形成脑瘤的报道 [7] 。CAR-T细胞产品由于引入外源基因以及病毒载体插入位点突变,使其可能具有致瘤性风险 [8] 。研究证据表明,干细胞来源的外泌体已经成为新型的无细胞治疗最有力的替代方法 [9] [10] 。
本研究将采用人脐带干细胞来源的外泌体治疗过敏性哮喘的小鼠模型,证明外泌体治疗过敏性哮喘小鼠模型的安全性和有效性及其使用剂量,并进一步探讨外泌体发挥作用的分子机制,为外泌体进一步应用于临床提供理论和实验依据。
2. 材料与方法
2.1. 人的脐带间充质干细胞的培养
人脐带组织标本由临沂市妇幼保健院(滨河院区)提供,且本研究经临沂市妇幼保健院伦理委员会批准,捐赠者知情同意。利用组织贴壁法分离培养脐带组织来源的干细胞,营养液成份由5% UltraGRO和含有0.032%医用肝素钠的α-MEM基础培养液组成。用消化传代培养法进行扩增培养并进行细胞纯度的鉴定,收集第3代至第4代的细胞培养上清。
2.2. 人脐带间充质干细胞外泌体的分离纯化
将人脐带间充质干细胞培养上清于4℃ 300×,离心10 min去除悬浮细胞和死细胞;4℃ 2000×g,离心10 min去除细胞碎片等杂质;使用0.22 um无菌滤器过滤上清液进一步去除细菌等杂质;4℃ 100,000×g,120 min超速离心得到外泌体沉淀,去除上清液后加入200 μl PBS洗涤一遍;再次4℃ 100,000×g,120 min超速离心,弃去上清液,加入100 μl PBS得到高纯度的间充质干细胞来源的外泌体;分装后于−80℃冰箱保存备用。
2.3. 人脐带间充质干细胞衍生外泌体的鉴定
2.3.1. 透射电子显微镜
外泌体透射电镜(TEM)检测采用阴性染色法。阴性染色时,取约10 μl外泌体重悬液于铜网板上,4℃下静置3 min;洗净网格并用滤纸吸干,然后于1%磷钨酸中负染色2 min,随即用蒸馏水洗涤,避光干燥。用透射电子显微镜(JEM-1200EX, JEOL)在120 kV下观察网格。图像由数码相机(软成像解决方案,Olumpus)拍摄。
2.3.2. 人脐带间充质干细胞衍生外泌体粒径和浓度的测定
使用NanoSight NS 300系统(NanoSight Technology, Malvern, UK)进行检测,将外泌体颗粒重悬于500 μL无菌PBS中,用0.22 μm注射器过滤器(Millipore)过滤。样品被稀释(1:4000),直到单个纳米颗粒可以被追踪。通过外泌体的布朗运动速率直接跟踪外泌体数量和大小,进行快速视频捕获和数据分析,检测外泌体的粒径的大小和浓度(粒子/ml)。
2.3.3. Western Blot鉴定
利用外泌体专用的裂解液对纯化的外泌体进行裂解用于western blot鉴定。所检测的蛋白分子分别是:CD63、CD9、HSP70;所使用的兔抗人的一抗如下:CD63单克隆抗体(1:500)、CD9单克隆抗体(1:500)和HSP70单克隆抗体(1:500);使用羊抗兔的二抗(1:10,000)鉴定外泌体的标志性蛋白分子的表达情况。
2.4. 小鼠过敏性哮喘模型的构建和干预治疗的方法
本研究使用雄性BALB/c鼠,6~8周龄,体重为20 g左右,分hUCMSCs-exos治疗组、模型组对照组、正常对照组和布地奈德治疗组对照组,每组5只;造模方法:第1天和第14天给予小鼠腹腔内注射0.2 ml含有OVA和AL(OH)3的混合液致敏,然后在第21天到第27天期间每天将致敏小鼠放入有机玻璃箱内给予雾化吸入5% OVA 30 min (见图1);正常对照组(CON)采用PBS雾化吸入30 min;布地奈德治疗组采用布地奈德(10 μg/ml)每天雾化治疗10 min;hUCMSCs-exos治疗组使用0.75 mg/ml的hUCMSCs-exos进行雾化治疗(10 min/天)。
造模或治疗结束后,眼周静脉丛采血法采静脉血;CO法处死小鼠,取肺组织和肺灌洗液。利用ELISA方法检测静脉血中的IgE及IL-4的水平;肺组织切片做HE染色;肺灌洗液进行白细胞总数和嗜酸性粒细胞计数。

Figure 1. Flow chart of constructing a mouse model of allergic airway inflammation
图1. 过敏性气道炎症小鼠模型构建的流程图
2.5. 支气管肺泡灌洗液(Bronchoalveolar Lavage Fluid, BALF)的收集和细胞计数
最后1次激发24 h内(第28天)将各组小鼠处死,无菌条件下分离气管,结扎左主支气管后,剪开右主支气管插入气管导管并固定,无菌生理盐水灌洗3次,1 mL/次,收集的BALF于4℃,1200 r/min离心5 min,弃去上清液,PBS重悬细胞沉淀,利用半导体激光流式细胞联合核酸荧光染色技术对小鼠BALF中白细胞总数进行计数,制备涂片并用瑞士染色计数BALF中嗜酸性粒细胞百分比。
2.6. 小鼠血液的采集和IgE及IL-4浓度的检测
将小鼠进行眼框取血,直接抗凝收集血液,2500 r/min离心3 min,取上层血浆,参照ELISA试剂盒(Elabscience)说明书检测各组小鼠血浆中IgE及IL-4浓度。
2.7. 统计分析
使用SPSS Statistics 26.0进行统计分析。采用Shapiro-Wilk检验进行正态性检验。采用Levene检验进行方差齐性检验。符合正态分布且具有方差齐性的计量资料采用单因素方差分析进行组间比较,采用LSD法进行两两比较;不符合正态分布或不具有方差齐性的计量资料采用Kruskal-Wallis H检验进行组间比较。检验的显著性水平为0.05 (双侧),统计图绘制在prism 9.0软件完成。
3. 结果
3.1. hUCMSCs-exos的鉴定
通过透射电子显微镜和Nanosight300检测从hUC-MSCs中分离的外泌体,成像表明从hUCMSCs分离的颗粒呈圆形或椭圆形,具有完整的半膜,具有典型的外泌体形态(图2(a))。使用Nanosight300分析脐带间充质干细胞外泌体,浓度为1.32 × 1011 particle mL−1 (图2(b))。粒径范围为50~200 nm之间,与报道的外泌体直径基本一致。通过Western Blot检测外泌体的标志性蛋白的表达,外泌体的裂解物显示出CD9、CD63和HSP70的强阳性条带(图2(c))。用作对照的hUC-MSCs细胞裂解物对外泌体标记蛋白产生的信号很弱甚至没有。
 (a) 通过透射电子显微镜观察hUCMSCs-exos的形态学(比例尺 = 100 nm)。(b) 通过纳米颗粒追踪分析评估外泌体直径分布。(c) 通过蛋白质印迹分析特定外泌体表面标志物的表达。(d) Nanosight300检测从hUC-MSCs中分离的外泌体的浓度。
(a) 通过透射电子显微镜观察hUCMSCs-exos的形态学(比例尺 = 100 nm)。(b) 通过纳米颗粒追踪分析评估外泌体直径分布。(c) 通过蛋白质印迹分析特定外泌体表面标志物的表达。(d) Nanosight300检测从hUC-MSCs中分离的外泌体的浓度。
Figure 2. Identification of hUCMSCs-exos by transmission electron microscopy and Nanosight 300
图2. 透射电子显微镜和Nanosight 300等方法鉴定hUCMSCs-exos
3.2. 各组小鼠IgE和IL-4浓度的检测
与正常对照组(CON)相比,哮喘组(OVA)的IgE及IL-4均有显著升高(图3,p < 0.01);与哮喘组(OVA)相比,布地奈德治疗组的IgE及IL-4均有降低(图3,p < 0.01),但hUCMSCs-exos治疗组的IgE (图3,p < 0.01)及IL-4 (图3,p < 0.05)呈现了不同程度的显著性降低;外泌体组与布地奈德治疗组的对比无差异基本相似。
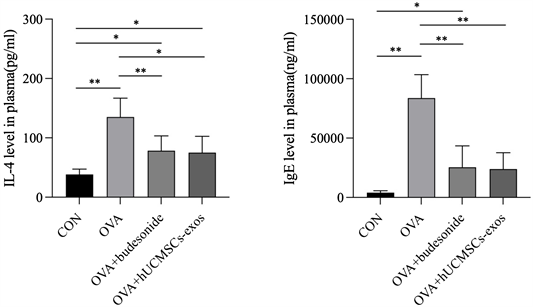 hUCMSC-exosomes吸入治疗后,利用ELISA法检测各组小鼠血浆中IL-4和IgE表达水平。CON (空白对照组);OVA (哮喘组);OVA + budesonide (布地奈德治疗组);OVA + hHUMSCs-exos (人脐带间充质干细胞外泌体治疗组)。*表示两两比较差异显著p < 0.05,**表示p < 0.01。
hUCMSC-exosomes吸入治疗后,利用ELISA法检测各组小鼠血浆中IL-4和IgE表达水平。CON (空白对照组);OVA (哮喘组);OVA + budesonide (布地奈德治疗组);OVA + hHUMSCs-exos (人脐带间充质干细胞外泌体治疗组)。*表示两两比较差异显著p < 0.05,**表示p < 0.01。
Figure 3. The influence of hUCMSC-exosomes on the expression of IL-4 and immunoglobulin IgE in mouse plasma
图3. hUCMSC-exosomes 对小鼠血浆中IL-4和免疫球蛋白IgE表达产生的影响
 通过半导体激光流式细胞核酸荧光染色技术计数小鼠的支气管细胞灌洗液(BALF)中,制备涂片并用瑞士染色计数BALF中嗜酸性粒细胞百分比。CON (空白对照组);OVA (哮喘组);OVA + budesonide (布地奈德治疗组);OVA + hHUMSCs-exos (人脐带间充质干细胞外泌体治疗组)。*表示两两比较差异显著p < 0.05,**表示p < 0.01。
通过半导体激光流式细胞核酸荧光染色技术计数小鼠的支气管细胞灌洗液(BALF)中,制备涂片并用瑞士染色计数BALF中嗜酸性粒细胞百分比。CON (空白对照组);OVA (哮喘组);OVA + budesonide (布地奈德治疗组);OVA + hHUMSCs-exos (人脐带间充质干细胞外泌体治疗组)。*表示两两比较差异显著p < 0.05,**表示p < 0.01。
Figure 4. The influence of UCMSC-exosomes treatment on the total number of leukocytes and eosinophils in mouse bronchoalveolar lavage fluid (BALF)
图4. 检测UCMSC-exosomes治疗对小鼠支气管肺泡灌洗液(BALF)中白细胞总数和嗜酸性粒细胞数量的影响
3.3. hUCMSCs-Exos干预治疗后细胞反应
肺泡灌洗液能够反应肺部的感染状态、炎症反应、免疫反应、肿瘤微环境等。嗜酸性粒细胞Eosinophil (ESO)倾向于积聚在过敏性炎症部位,有助于支气管哮喘的发生和发展,肺部的ESO能够直接影响肺部的T细胞活性,调节TH1与TH2反应之间因子的表达。与正常对照组(CON)相比,哮喘组(OVA)肺泡灌洗液中白细胞总数及嗜酸性粒细胞百分比均显著升高(图4,p < 0.01);布地奈德治疗组和hUCMSCs-exos治疗组肺泡灌洗液中白细胞总数及嗜酸性粒细胞百分比均明显升高(图4,p < 0.01)。与哮喘组(OVA)相比,hUCMSCs-exos治疗组和布地奈德治疗组肺泡灌洗液中白细胞总数及嗜酸性粒细胞百分比均显著降低(如图4,p < 0.01);而与布地奈德治疗组相比,hUCMSCs-exos治疗组肺泡灌洗液中的嗜酸性粒细胞百分比的降低最为显著(如图4,p < 0.05),白细胞总数的差异无统计学意义。
4. 讨论
过敏性哮喘严重影响人类的健康,且其发病率每年以5%的速度增长。过敏性哮喘是由于免疫系统先天和适应性分支之间复杂的相互作用,主要以2型T辅助淋巴细胞(Th2)驱动而引起的免疫炎症反应 [11] 。OVA诱导的过敏性气道炎症模型已广泛地用于研究过敏原诱导的Th2细胞细胞因子分泌,其触发嗜酸性粒细胞募集、IgE产生和杯状细胞增生 [12] 。在目前的研究中,hUCMSCs-exos对过敏性哮喘小鼠模型进行治疗,能够减少免疫细胞积累和粘液分泌,有效降低了炎症细胞,尤其是嗜酸性粒细胞的浸润和细胞因子的释放,显示了hUCMSCs-exos治疗对过敏反应具有抑制作用。
1983年,外泌体首次于绵羊网织红细胞中被发现,1987年Johns-tone将其命名为外泌体(exosome)。多种细胞在正常及病理状态下均可分泌外泌体,其主要来源于细胞内溶酶体微粒内陷形成的多囊泡体,经多囊泡体外膜与细胞膜融合后释放到胞外基质中。随着外泌体的研究进展,更准确的分子机制参与细胞间交流的过程已经被揭示;特别是microRNAs (miRNAs)和长链非编码RNA (lncRNAs)都由外泌体穿梭。此外,外泌体可能在多种呼吸道疾病的发病机制中发挥重要作用,如慢性阻塞性肺疾病(COPD)、肺癌和哮喘。因此,外泌体在多种肺部疾病中显示出作为诊断生物标志物和治疗靶点的前景 [13] 。
由于外泌体广泛参与细胞之间的交流,外泌体的临床研究在治疗不同疾病中都显示了明显疗效。据报道MSCs来源的外泌体(MSCs-derived exosomes, MEX)所含生物活性物质促进组织损伤修复 [12] 。Bruno等 [14] 研究表明,MEX中的mRNA主要与促增殖、转录调控以及免疫调节有关,对肾损伤发挥修复作用。Zhu等 [15] 研究了MEX中mRNA与急性肺损伤修复间的关系,研究发现外泌体包含角质细胞生长因子,它从BMSCs转运至肺泡二型上皮细胞,并翻译KGF蛋白,可以抑制免疫反应,减少肺组织损伤。
肺部具有巨大的肺泡表面积、肺泡细胞膜较薄、丰富的毛细血管网、狭小的气血通路、低酶活性、肺深处较慢的清除速率等生理解剖特点。与其他给药途径相比,雾化吸入给药具有药物用量小、吸收表面积大、起效迅速、避免肝首过效应、全身副作用小、使用方便等优点。布地奈德作为吸入性糖皮质激素药物是目前过敏性哮喘的首选局部抗炎药物,能增强内皮细胞、平滑肌细胞和溶酶体膜的稳定性,抑制免疫反应和降低抗体合成,从而使组胺等过敏活性介质的释放减少和活性降低,抑制支气管收缩物质的合成和释放从而减轻平滑肌的收缩反应,但是其不良反应也很明显。本研究以布地奈德雾化治疗组作为对照组,研究结果显示hUCMSCs-exos组达到了相似的治疗效果。
Interleukin 4 (IL-4)是CD4+T细胞亚群、B细胞、肥大细胞等分泌的多效性细胞因子,可促进B细胞合成的抗体向IgE转换。Immunoglobulin E (IgE)是介导Ⅰ型变态反应的主要抗体。IgE和IL-4的浓度的高低与过敏原的致敏效果呈正相关。人类IL-4属于Th2细胞因子家族,介导I型过敏反应的肥大细胞等其它细胞也可以产生IL-4。IL-4对于B细胞、T细胞、肥大细胞、巨噬细胞和造血细胞都有免疫调节作用。小鼠的IL-4也主要由Th2亚群产生 [16] [17] [18] 。
免疫球蛋白lgE存在于外周血中,是正常人血清中含量最少的免疫球蛋白,其主要功能是介导I型超敏反应。lgE有能够与肥大细胞和嗜碱性粒细胞结合的免疫功能 [19] [20] 。有研究证明,在小鼠体内适宜条件下IL-4可以诱导IgE的分泌,IgE产生的量与小鼠过敏哮喘的严重程度成正比 [21] 。
本研究证明应用hUCMSCs-exos治疗过敏性哮喘可以减轻哮喘的炎症反应,降低哮喘小鼠内炎症细胞因子分泌。同时发现外泌体对于哮喘小鼠的治疗效果要比布地奈德的治疗效果更好,这一研究发现将会带来巨大的社会效益;随着临床研究的和外泌体产品完善,外泌体产品的应用临床指日可待。
5. 结论
从实验结果来看,hUCMSCs-exos与抗哮喘药布地奈德的作用效果相似,甚至优于布地奈德治疗效果。这为哮喘的治疗提供了新的方法,并拓宽了这种基于外泌体的无细胞疗法的前景。
基金项目
临沂市医药科技计划项目(202120074);临沂市妇幼保健院院内资助项目(Y2021MS05)。
参考文献
NOTES
*共同第一作者。
#通讯作者。