1. 引言
卵巢交界性上皮肿瘤(borderline epithelial ovarian tumor, BEOT)占上皮性肿瘤的15%~20% [1] ,通常介于良性和恶性之间,生长缓慢且缺乏间质浸润,但具有癌变风险 [2] [3] 。卵巢交界性浆液性肿瘤(serous borderline ovarian tumor, SBOT)是BEOT最常见的病理类型,占所有BEOT患者的50%~55% [4] 。由于SBOT缺乏特征性临床表现,有其独特治疗策略及预后,有研究表明 [5] [6] [7] ,SBOT与卵巢良性囊性病变(ovarian benign cystic lesion, OBCL)在影像学上表现有相似性,交界性肿瘤组误诊率高,因此在术前明确SBOT诊断对最佳手术方式的选择与患者预后至关重要 [8] [9] [10] 。影像组学是基于标准影像图像,提取感兴趣区影像组学特征,将其转化为定量数据,建立模型进行分析,达到判断病变性质的目的 [11] [12] 。本文通过基于MRI的T2WI和DWI序列图像的影像组学技术来鉴别SBOT,以期辅助临床提高术前诊断SBOT和OBCL的准确率。
2. 资料与方法
2.1. 临床资料
选取2017年1月至2021年12月西北妇女儿童医院就诊并经手术病理证实的42例SBOT和56例OBCL患者的MRI资料。SBOT组42例,年龄14~80岁,中位年龄35岁,平均年龄(39 ± 14.8)岁;OBCL组56例,年龄13~74岁,中位年龄44岁,平均年龄(42 ± 14.7)岁。
入组标准:1) 有明确的手术病理结果,病灶以完全囊性或囊性为主;2) 术前行常规MRI平扫 + DWI序列;3) 所有入组患者临床资料完整,可反复调阅。排除标准:1) 与研究目的不一致的其他卵巢肿瘤(包括实性为主浆液性交界性肿瘤);2) MRI序列不全或图像质量较差;3) MRI图像肿瘤显示不完整。本研究通过西北妇女儿童医院医学伦理委员会伦理审查,免除受试者知情同意,批件编号:(NO):21-045。
2.2. 检查方法
采用GE 1.5T Signa HDxt超导型磁共振扫描仪,使用相控阵8通道体部线圈,受检患者采用仰卧位。患者于采集前需排便,并且膀胱适度充盈。扫描序列及参数:常规扫描层厚5.0 mm,层间距1.0 mm,FOV 350 mm × 350 mm。选用FSE序列,包括横断位T1WI序列(TR 580 ms, TE 8 ms)、T2WI及T2WI抑脂序列(TR 2700 ms, TE 65 ms)及横断位扩散加权成像(DWI)序列(TR 5000 ms, b = 1000 s/mm2)扫描。扫描范围包含子宫及两侧附件区域,巨大病灶则需扩大范围扫描。
2.3. 图像分割及特征提取
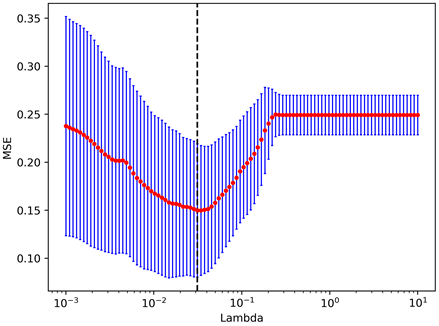
将MRI扫描T2WI和DWI图像导入3D Slicer软件(4.11.20210226, https://commonfund.nih.gov/bioinformatics)进行图像分割。图像三维感兴趣区域(region of interest, ROI)的逐层分割由两位具有十年以上工作经验的且不知道患者临床及病理资料的影像科医师完成。ROI范围包括了整个肿瘤病灶,且其他MRI序列作为ROI勾画的参考,以尽可能区分肿瘤与正常组织的边界(图1)。随后使用基于Python (version3.6)中的Pyradiomics (version3.0, http://pyradiomics.html),分别从T2WI序列及DWI序列的原始图像、小波变换后图像以及Laplacian of Gaussian (Log, sigma = 2, 3, 4, 5)滤波后图像中提取病灶特征共2446个,包括7类型:形状(shape)、一阶特征(first order)、灰度共生矩阵(GLCM)、灰度运行长度矩阵(GLRLM)、灰度区域大小矩阵(GLSZM)、灰度相关矩阵(GLDM)、领域灰度差异矩阵(NGTDM)。对特征数据进行Z值变换标准化处理,使用LASSO特征筛选,模型正则化参数Lambda选择范围设置为(10−3, 10),取之间相同间隔的100个数,采用10折交叉验证迭代1000次辅助模型自动选择最佳的正则化参数Lambda,T2WI序列、DWI序列、T2WI + DWI序列分别最终选择参数Lambda = 0.045、Lambda = 0.037、Lambda = 0.031并分别从1223个、1223个、2446个特征中选择21个、27个、39个最终选择参数,作为建模的特征参数。T2WI + DWI序列误差棒图如图2(a)所示,每个特征系数随Lambda的变化如图2(b)所示,所选择特征如表1所示。
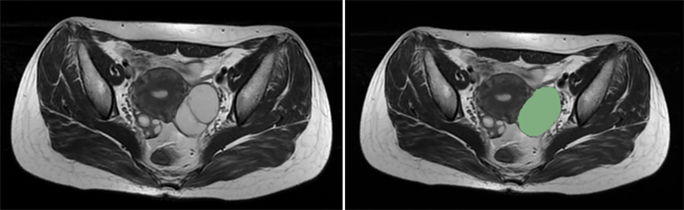
Figure 1. Borderline serous tumor, with the region of interest delineated along the tumor edge
图1. 交界性浆液性肿瘤,沿肿瘤边缘勾画感兴趣区

Table 1. LASSO screening feature variables
表1. LASSO筛选特征变量
 (a)
(a)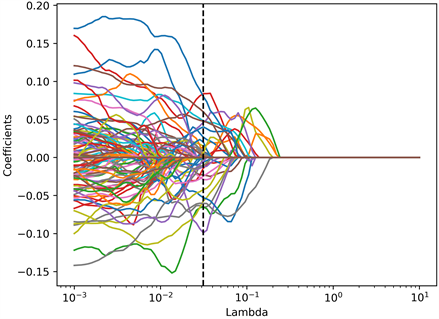 (b)(a) 误差棒图:选择误差最小处的Lambda为最优值(垂直虚线处);(b) 特征系数变化图:根据最优Lambda值选择非零参数,得出最具有预测价值的39个影像组学特征。
(b)(a) 误差棒图:选择误差最小处的Lambda为最优值(垂直虚线处);(b) 特征系数变化图:根据最优Lambda值选择非零参数,得出最具有预测价值的39个影像组学特征。
Figure 2. Feature selection diagram based on LASSO regression
图2. 基于LASSO回归特征选择图
2.4. 统计学分析
应用SPSS 23.0软件,计量资料用均数 ± 标准差(
)表示,计数资料以例数及率(%)表示。组间比较,正态分布采用独立样本t检验或偏态分布采用秩和检验。绘制ROC曲线进行诊断效能分析。
影像组学的特征选择和预测模型构建中的统计学方法均在Python软件上进行。构建逻辑回归(logistic regression, LR)模型进行分类训练。采用留一法交叉验证评估模型性能,使用准确度(accuracy)、F1值(F1-score)、敏感度(sensitivity)、特异度(specificity)、受试者工作特征(receiver operating characteristic, ROC)曲线及曲线下面积(area under curve, AUC)作为评估指标。De Long检验在Python软件上进行。P < 0.05为差异有统计学意义。
3. 结果
3.1. 不同影像组学模型的效能评估
T2WI影像组学模型、DWI影像组学模型、T2WI + DWI双参数联合影像组学模型及影像医师诊断结果对SBOT和OBCL的诊断效能比较见表2。表2列出了3种模型及影像医师诊断结果的准确度、F1值、敏感度、特异度和AUC值,其中3种模型的ROC曲线如图3显示,无论是单参数影像组学模型还是双参数联合影像组学模型对SBOT和OBCL的鉴别都有一定的诊断效能。T2WI + DWI双参数联合影像组学模型分类训练的混淆矩阵如图4显示,图中标签0代表良性,标签1代表交界性,横坐标代表预测类别,纵坐标代表真实类别,由混淆矩阵可以看出交界性发生误判大于良性。

Table 2. Comparison of diagnostic efficiency of each model
表2. 各模型诊断效能对比
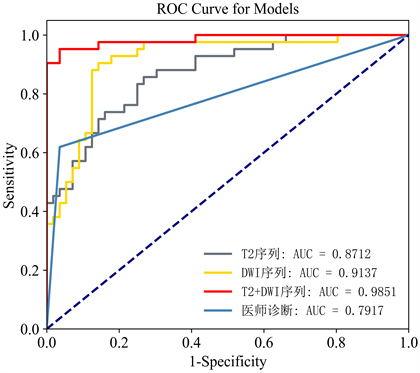
Figure 3. ROC curves of the three models and the diagnosis by the radiologist
图3. 三种模型及医师诊断的ROC曲线
3.2. 影像医师MRI诊断结果的诊断效能
与病理结果对照,影像医师MRI诊断结果见表3。诊断效能采用ROC曲线进行分析(图3)。其曲线下面积(AUC)为0.792,敏感度0.619,特异度0.964,准确度0.816,如表2。
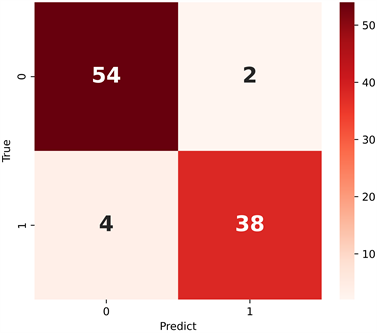
Figure 4. Confusion matrix of classification training of the combined T2WI + DWI two-parameter imageology model
图4. T2WI + DWI双参数联合影像组学模型分类训练的混淆矩阵

Table 3. Diagnostic results cross-table of radiologists using MRI plain scans and enhanced images to distinguish SBOT and OBCL
表3. 影像医师基于MRI平扫 + 增强的图像鉴别SBOT和OBCL的诊断结果交叉表
3.3. 影像医师MRI诊断与影像组学诊断模型间的诊断效能比较
通过Delong检验,影像医师MRI诊断和影像组学模型的AUC值有统计学差异(P < 0.05),且T2WI + DWI双参数联合影像组学模型得到的AUC值最优(0.98),显著高于影像医师的AUC值(0.79)。
4. 讨论
本研究SBOT和OBCL患者中位年龄分别是35岁和44岁,好发于育龄期女性,临床表现缺乏特异性,约有42%的SBOT患者和46%的OBCL患者无症状,在妇科查体或妇科超声检查中偶然发现病灶,有症状患者有不同程度的腹痛、腹胀、尿频及阴道流血等症状,这与专家共识等研究结果 [13] [14] 基本一致。病理诊断虽然是诊断SBOT的金标准,但术中冰冻诊断率并不高,会造成不必要的子宫附件切除或二次手术 [15] 。MRI对软组织分辨率比较敏感,术前行MRI检查有助于鉴别,但作用相对有限 [14] [16] ,与本研究医师诊断准确率81.6%相符。所以对于需要保留生育功能的患者来说,提高MRI术前诊断正确率的诊断方法尤为重要。
目前影像组学在SBOT和OBCL的鉴别诊断方面已有了初步的研究,潘淑淑等人 [17] 建立基于增强CT的影像组学模型,验证了影像组学模型在鉴别SBOT和OBCL有较高的效能,其AUC值为0.90高于本研究T2WI模型(AUC = 0.89),低于DWI模型(AUC = 0.91)及双参联合数模型(AUC = 0.98),表明T2WI + DWI联合的影像组学模型较基于增强CT的影像组学模型对SBOT和OBCL的鉴别诊断可能更具优势。胡艳等人 [8] 基于T2WI提取1288个影像组学特征,用4种不同的特征筛选方式及7种不同的机器学习模型,结果显示良性组和交界性组的AUC最高分别可达0.97和0.93 (特征筛选使用递归特征消除法,机器学习模型使用K近邻分类器)。本研究基于T2WI和DWI图像提取更多的影像组学特征(2446个),并经降维得到了36个特征参数(11个一阶特征、9个灰度共生矩阵、3个灰度运行长度矩阵、8个灰度区域大小矩阵、5个灰度相关矩阵),随后分别建立T2WI模型、DWI模型和T2WI + DWI联合模型进行分类训练,预测模型鉴别诊断效能的ROC曲线下面积分别为0. 89、0.91、0.98,表明双参数联合模型优于单参数模型,模型对鉴别S-BOT和OBCL有较高的诊断效能。
交界性肿瘤在影像上的表观特征可能与良性和恶性卵巢肿瘤相似或重叠,且一定程度上依赖于影像医师的经验进行主观评估 [18] 。彭晓澜等人 [7] 研究显示MRI在附件囊实性占位鉴别诊断中,交界性肿瘤组误诊率最高,其敏感度仅52.0%,特异度94.0%,准确度为85.6%,与本研究影像医师诊断的敏感度61.9%,特异度96.4%,准确度81.6%,基本相符。相较于影像医师诊断,影像组学在卵巢肿瘤诊断方面是具有更加客观、可重复性更高的诊断方法。本研究中,T2WI + DWI联合影像组学方法得到的最优AUC值(0.98)显著高于影像医师诊断的AUC值(0.79),Delong检验P < 0.005,有统计学意义,表明在SBOT和OBCL的鉴别诊断中,影像组学的诊断效能优于影像医师诊断,能够提高低年资影像诊断医师对SBOT和OBCL的诊断准确率。
本文存在的不足:1) 本文结果是小样本单中心的分析,会影响模型的泛化能力,今后将进一步扩大样本量、增加外部验证做补充总结;2) 本文是回顾性分析,在图像数据选择方面由于时间跨度大难免出现偏差。
综上,基于联合T2WI + DWI图像的影像组学特征构建的分类器模型可以有效地鉴别SBOT和OBCL,可以为临床治疗方法的选择提供辅助作用。
参考文献
NOTES
*第一作者。
#通讯作者。