1. 引言
乙型肝炎病毒(HBV)感染是慢性肝炎、肝纤维化、肝硬化和肝细胞癌(HCC)等疾病的主要危险因素之一,也是一个重大的全球健康问题 [1] 。全世界有超过3.5亿人慢性感染HBV,每年约有100万人死于HBV相关并发症,慢性HBV感染可引起肝纤维化 [2] [3] ,据报道有25%~40%的肝纤维化患者后期发展为肝硬化、肝衰竭,甚至肝癌导致死亡 [4] 。
microRNAs (miRNAs)是一种长度为19~25个核苷酸的非编码小RNA,通过与信使RNA (mRNA)相互作用,在转录后发挥调控功能 [5] 。失调的miRNAs对细胞存活、生长、转移和分化等一系列细胞生物学行为具有重要影响 [6] 。越来越多的证据表明,在多种类型人类疾病中被发现存在miRNAs的失调 [7] 。研究证实microRNA-122-5p (miR-122-5p)参与了人类肿瘤和其他疾病,如鼻咽癌 [8] ,儿童肥胖 [9] 、胰腺癌 [10] 以及肝细胞癌 [11] 。然而,miR-122-5p是否介导HBV相关性肝纤维化的发病机制仍不清楚。环状RNA (Circular RNAs, circRNAs)是作为一类主要的非编码RNA分子具有组织限制性和癌症特异性表达模式,可通过不同的作用机制在癌症的发生和进展中发挥关键作用 [12] [13] 。许多环状RNA也已被证实在肝细胞癌中发挥重要作用 [14] 。例如,抑制circ_RPS16的表达可以在活体水平抑制肝癌移植瘤的生长 [15] ,circ_104348在HCC组织和细胞中表达显著上调,circ_104348水平高的HCC患者预后较差 [16] 。然而,Circ_MTM1在HBV诱导肝纤维化中的作用尚不清楚。本文主要研究,miR-122-5p通过靶向Circ_MTM1对HBV相关性肝纤维化中的作用和潜在机制。
2. 材料和方法
2.1. 细胞培养
LX-2细胞(人肝星状细胞)购自中科院生化细胞实验室(中国,上海)。培养液采用DMED培养液加10%胎牛血清(FBS;购于Invitrogen公司,美国),抗生素选用100 U/mL的青霉素和100 μg/mL的链霉素(购于Hyclone公司,美国),细胞培养条件为37℃、5%二氧化碳的温箱,在37℃下,用1012/LHBV感染LX-2细胞36小时,随后,用10 ng/mLTGF-β1 (购于R&D Systems公司,美国)处理细胞36小时。
2.2. 组织样本
选取2021年07月~2023年08月锦州医科大学附属第一医院确诊的32例HBV相关性肝纤维化患者的肝纤维化组织及其相邻正常组织。所有患者经B超、血清学检测和肝穿刺证实,诊断为HBV相关性肝纤维化,并且无肿瘤、糖尿病等免疫学疾病。该研究已通过锦州医科大学伦理委员会批准,并根据《赫尔辛基宣言》的道德准则进行,且该实验获得患者的同意并签订知情同意书。
2.3. 乙型肝炎表面抗原(HBsAg)和e抗原(HBeAg)检测
分别收集HBV感染、TGF-β1处理、转染不同时间的LX-2细胞培养上清,之后将上清液2500 rpm离心5 min,−20℃静置后使用。采用HBsAg和HBeAg ELISA试剂盒(购于Abcam公司,英国)检测HBsAg和HBeAg,按标准流程分析。
2.4. HBV DNA和HBV cccDNA检测
HBV DNA的分离和检测分别采用血液和细胞培养DNA试剂盒(购于QIAGEN公司,德国)和HBV DNA检测诊断试剂盒(购于达安公司,中国)。cccDNA的特异性引物如下:GCCTATTGATTGGAAAGTATGT (正向)和AGCTGAGGCGGTATCTA (反向),以插入质粒的单基因型D型HBV作为定量标准。
2.5. RNA提取和实时定量聚合酶链式反应
应用Trizol试剂(购于Invitrogen公司,美国)根据标准流程从HBV相关肝纤维化组织和细胞中分离提取RNA。采用SuperScript IV CellsDirect cDNA合成试剂盒(购于Invitrogen公司,美国)将mRNA反转录为cDNA,并按SYBR Green Master Mix (ThermoFisher)的RT-qPCR系统说明扩增并检测mRNA,确定特异性基因扩增转录水平。以U6和GAPDH作为内参,对miR-122-5p、Circ_MTM1进行标准化控制。应用的特异性引物如下:Circ_MTM1:正向引物GCGACAAGTAGAGGAGAA,反向引物AGAAGTTGATGCAGAAGC,miR-122-5p:正向引物GTGACAATGGTGGAATGTGG,反向引物AAAGCAAACGATGCCAAGAC,U6:正向引物CTCGCTTCGGCAGCACA,反向引物AACGCTTCACGAATTTGCGT,GAPDH:正向引物AAGGCTGAGAATGGGAAAC,反向引物TTCAGGGACTTGTCATACTTC。采用2−∆∆Ct法计算并检测miR-122-5p和Circ_MTM1的表达。
2.6. 双荧光素酶报告检验检测
将含有野生型(WT)或突变型(MUT) miR-122-5p结合位点的Circ_MTM1序列插入pGL3启动子载体(购于Invitrogen公司,美国)中构建报告载体:Circ_MTM1-WT (野生型),Circ_MTM1-MUT (突变型)。然后将HBV感染LX-2细胞和HBV与TGF-β1共处理的LX-2细胞,分别用萤火虫荧光素酶报告载体(Circ_MTM1-WT或Circ_MTM1-MUT)、肾素荧光素酶报告载体和miR-NC或miR-122-5p共转染。转染48小时后,采用双萤光素酶检测系统测量萤光素酶的相对活性,用萤火虫萤光素酶活性和海肾萤光素酶活性比值表示萤光素酶的相对活性。
2.7. Western Blot
取1.3处理的细胞,用RIPA裂解液(购于Beyotime公司,中国)提取总蛋白,置于10%~12%聚丙烯酰胺凝胶电泳(SDS-PAGE)分离蛋白后转膜(PVDF),然后用5%脱脂牛奶在室温下封膜2 h。再加入细胞增殖核抗原(PCNA,1:1000,购于Abcam公司,英国)、基质金属蛋白酶2 (MMP2,1:1000,购于Abcam公司,英国)、α-平滑肌肌动蛋白(α-SMA,1:2000,购于Abcam公司,英国)、人I型胶原α1链蛋白(COL1A1,1:1000,购于Abcam公司,英国)和甘油醛-3-磷酸脱氢酶(GAPDH,1:1000,购于Abcam公司,英国)于4℃封闭过夜。接着加入对应山羊抗兔二抗(1:2000,购于Abcam公司,英国)室温封闭1.5 h,然后滴电化学反应液曝光,以GAPDH为内参,使用Quantity One软件分析蛋白条带灰度,最后以目标蛋白与内参蛋白GAPDH积分光密度(integrated-optical density, IOD)比值表示蛋白的表达水平。
2.8. 统计学分析
所有统计数据采用SPSS 22.0处理,图形使用GraphPad Prism 6.0软件构建。实验数据以`x ± s表示,组间比较采用one-way ANOVA分析,组间差异采用学生t检验。P < 0.05认为有统计学意义。
3. 结果
3.1. Circ_MTM1在HBV感染的LX-2细胞和肝纤维化组织中高度表达
为研究HBV在LX-2细胞中的复制情况,先将LX-2细胞与HBV在培养基中共同孵育36 h,HBV可转染LX-2细胞中成功复制,并在体外表达HBs和HBe (见图1(A)),HBsAg和HBeAg在HBV感染的LX-2细胞中较比未处理的LX-2细胞中表达上调。同时,HBV感染也导致了LX-2细胞中的HBV DNA水平上调(见图1(B))。同时在HBV感染的LX-2细胞中检测到病毒转录模板cccDNA (见图1(C))。这些结果表明感染成功,且转化生长因子β1蛋白(TGF-β1)在HBV相关肝纤维化的肝损伤中发挥重要作用。因此,将HBV感染的LX-2细胞与10 ng/mL TGF-β1共同孵育36 h,检测纤维化相关蛋白(α-SMA、COL1A1、MMP2和PCNA)水平。Western blot实验结果显示,与未经TGF-β1处理的HBV感染LX-2细胞相比,TGF-β1显著上调α-SMA、COL1A1、MMP2和PCNA蛋白水平(见图1(D))。然后继续检测HBV感染的LX-2细胞和肝纤维化组织中Circ_MTM1的表达。与未处理的细胞相比,Circ_MTM1在HBV感染的LX-2细胞中表达量增加,并在TGF-β1和HBV联合处理的细胞中表达量进一步增加(见图1(E))。此外,我们发现,与正常肝组织相比Circ_MTM1在HBV相关肝纤维化组织中表达上调(n = 32) (见图1(F))。综上,结果表明Circ_MTM1在HBV相关的肝纤维化组织和细胞中高表达。
3.2. Circ_MTM1基因敲低可减弱HBV诱导的肝纤维化
为研究Circ_MTM1在HBV相关性肝纤维化中的潜在机制,将HBV相关性肝纤维化转染后分组si-NC和si-circ_MTM1。RT-qPCR结果显示,转染si-circ_MTM1组在HBV感染的LX-2细胞以及HBV感染和TGF-β1诱导的LX-2细胞中显著抑制了circ_MTM1的表达(见图2(A)~(B))。敲低Circ_MTM1可显著抑制HBV感染LX-2细胞中的HBsAg和HBeAg水平(见图2(C))。此外,我们观察到,在Circ_MTM1敲低的HBV感染LX-2细胞中,HBV DNA和cccDNA水平下调(见图2(D)~(E))。而且,western blot实验结果显示,Circ_MTM1敲低也可以抑制HBV和TGF-β1联合处理LX-2细胞中α-SMA、COL1A1、MMP2和
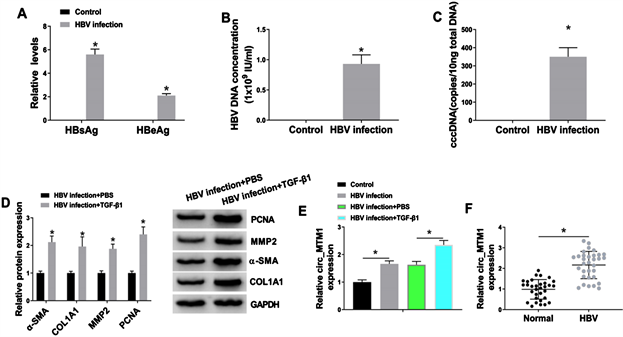
(A) 分别用HBsAg和HBeAg ELISA试剂盒检测HBsAg和HBeAg水平。
(B-C) 采用RT-qPCR检测HBV DNA和cccDNA水平。
(D) Western blot检测PCNA、MMP2、α-SMA和COL1A1的表达。
(E) RT-qPCR检测LX-2细胞中Circ_MTM1水平。
(F) RT-qPCR检测HBV相关肝纤维化组织中Circ_MTM1的表达。*P < 0.05。
图1. Circ_MTM1在HBV相关肝纤维化组织和细胞中上调

HBV感染的LX-2细胞,HBV与TGF-β1联合处理的LX-2细胞分别转染si-circ_MTM1或si-NC。
(A-B) RT-qPCR检测Circ_MTM1和MTM1水平。
(C) 分别用HBsAg和HBeAg ELISA试剂盒检测HBV感染LX-2细胞的HBsAg和HBeAg。
(D) 用RT-qPCR检测HBV感染LX-2细胞的HBV DNA水平。
(E) 采用RT-qPCR检测HBV感染LX-2细胞中cccDNA水平。
(F) Western blot检测HBV和TGF-β1联合作用LX-2细胞中PCNA、MMP2、α-SMA和COL1A1的表达。*P < 0.05。
图2. Circ_MTM1基因敲减HBV相关性肝纤维化
的蛋白水平(见图2(F))。综上,数据表明Circ_MTM1在HBV感染和HBV相关性肝纤维化中起促进作用。
3.3. Circ_MTM1是miR-122-5p的靶基因
为了解Circ_MTM1的作用,我们首先通过生物信息学软件StarBaseV3.0预测了Circ_MTM1潜在的靶向miRNAs,其中miR-122-5p包含了Circ_MTM1的结合位点(见图3(A))。然后通过双荧光素酶报告基因检测技术来验证此相关性,在HBV或HBV感染和TGF-β1共同处理的LX-2细胞中,与转染miR-NC组相比,转染miR-122-5p组明显降低了Circ_MTM1-WT组的荧光素酶活性,而对Circ_MTM1-MUT组的荧光素酶活性影响较小(见图3(B)~(C))。RT-qPCR结果显示,敲低Circ_MTM1可促进HBV感染的LX-2细胞以及HBV感染和TGF-β1联合处理的LX-2细胞中的miR-122-5p的表达(图3(D)~(E))。此外,在HBV感染的LX-2细胞组中miR-122-5p表达下调,而在HBV感染和TGF-β1处理组miR-122-5p表达降低(见图3(F))。而且,在HBV相关肝纤维化组织中同样发现miR-122-5p表达降低(n = 32) (见图3(G))。我们发现Circ_MTM1表达与miR-122-5p表达水平呈负相关(r = −0.4961, P = 0.0039) (见图3(H))。综上,数据表明,miR-122-5p是Circ_MTM1的一个靶点,并且受到Circ_MTM1的负向调控。
3.4. miR-122-5p抑制剂可逆转Circ_MTM1对HBV相关肝纤维化下调的影响
为进一步探讨Circ_MTM1是否通过调控miR-122-5p对HBV相关性肝纤维化的抑制作用,我们采用

(A) StarBaseV3.0预测miR-122-5p包含Circ_MTM1的结合位点。
(B-C) 采用双荧光素酶报告基因测定miR-NC或miR-122-5p与Circ_MTM1-WT或Circ_MTM1-MUT共转染细胞的荧光素酶活性。
(D-E) RT-qPCR检测转染si-circ_MTM1或si-NC的HBV感染LX-2细胞以及HBV和TGF-β1联合处理的LX-2细胞中miR-122-5p水平。
(F) RT-qPCR检测HBV或TGF-β1处理LX-2细胞中miR-122-5p的表达。
(G) RT-qPCR检测HBV相关肝纤维化组织中miR-122-5p的水平。
(H) 采用Pearson相关分析方法分析Circ_MTM1与miR-122-5p的相关性(r = −0.4961, P = 0.0039)。*P < 0.05。
图3. Circ_MTM1直接靶向miR-122-5p
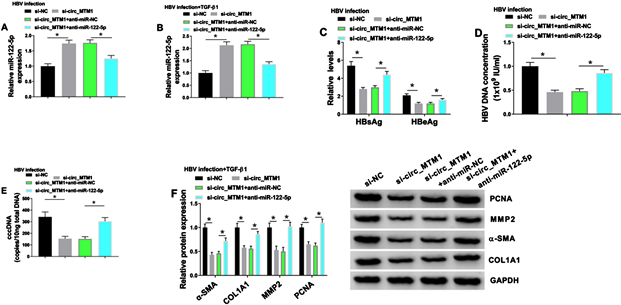
HBV感染的LX-2细胞以及HBV和TGF-β1联合处理的LX-2细胞分别转染si-NC、si-circ_MTM1、si-circ_MTM1 + anti-miR-NC或si-circ_MTM1 + anti-miR-122-5p。
(A-B) RT-qPCR检测miR-122-5p水平。
(C) 采用HBsAg和HBeAg ELISA试剂盒分别检测HBsAg和HBeAg水平。
(D-E) 采用RT-qPCR检测HBV DNA和cccDNA水平。
(F) Western blot检测PCNA、MMP2、α-SMA和COL1A1蛋白水平。*P < 0.05。
图4. miR-122-5p抑制剂逆转了Circ_MTM1敲低对HBV相关肝纤维化的影响
miR-122-5p抑制剂进行挽救实验。在HBV感染的LX-2细胞以及HBV感染和TGF-β1联合处理的LX-2细胞中,miR-122-5p抑制剂显著逆转了Circ_MTM1敲低miR-122-5p表达的上调作用(见图4(A)~(B))。在HBV感染的LX-2细胞中,我们发现Circ_MTM1基因的敲低显著降低了HBsAg和HBeAg的水平,而上述作用可被miR-122-5p抑制剂部分挽救(见图4(C))。此外,miR-122-5p抑制剂阻断了在HBV感染LX-2细胞中的HBV DNA和cccDNA水平因Circ_MTM1敲低的抑制作用(见图4(D)~(E))。同时,WesternBlot实验结果证明,在HBV感染和TGF-β1共同作用的LX-2细胞中,miR-122-5p下调显著逆转了Circ_MTM1敲低对α-SMA、COL1A1、MMP2和PCNA蛋白水平的抑制作用(见图4(F))。综上,结果证明Circ_MTM1可以通过调控miR-122-5p对HBV感染和HBV相关性肝纤维化的进展发挥作用。
4. 讨论
越来越多的证据显示,miRNAs在肝纤维化进程中发挥重要作用,miRNA充当基因表达的主要调节剂。在肝纤维化中存在大量miRNA的异常表达,如miR-133b低表达可能参与慢性乙型肝炎肝纤维化患者发生发展过程 [17] ,circRNA97被证明可以通过调控miR-146b-5p/HIPK1通路,显著抑制体外的肝星状细胞活化,并在大鼠体内实验中抑制大鼠肝纤维化进程,是肝纤维化的一个潜在性的分子标志物和医治靶标 [18] 。林等的研究发现miR-155-5p促进肝星状细胞的活化、迁移、氧化应激及胶原生成 [19] 。miR-195-3p可通过抑制PTEN的表达促进肝星状细胞活化及肝纤维化的发展 [20] 。本研究表明,miR-122-5p是Circ_MTM1的一个靶点,并且可以被Circ_MTM1负向调控。同时HBV相关肝纤维化组织和细胞中发现miR-122-5p下调。此外,miR-122-5p抑制剂部分逆转了Circ_MTM1敲低对HBV感染和HBV相关肝纤维化的抑制作用。
HBV DNA水平是乙型肝炎病毒感染的关键因素,与肝硬化风险的增加密切相关 [21] 。此外,HBV cccDNA在抗病毒治疗耐药性和病毒持久性中起着至关重要的作用,也是HBV感染的一个标志 [22] [23] 。TGF-β1通过激活肝星状细胞在HBV相关肝损伤中发挥重要作用 [24] 。在本文研究中,将LX-2细胞感染HBV,且HBV感染细胞中的HBsAg、HBeAg、HBV DNA、cccDNA等HBV感染标志物水平升高。在HBV感染LX-2细胞中,纤维化相关蛋白PCNA、MMP2、α-SMA、COL1A1的表达进一步升高,证明TGF-β1促进了HBV感染LX-2细胞的肝纤维化。环状RNA在肝纤维化的发展进程中发挥重要作用,据报道,circ_0070963可以通过调控miR-223-3p和LEMD3抑制肝纤维化 [25] 。在我们的研究中,首次发现circRNA Circ_MTM1参与调节HBV相关肝纤维化的发展,并且可检测HBV相关肝纤维化的Circ_MTM1水平。Circ_MTM1在HBV相关肝纤维化细胞和组织中高表达,Circ_MTM1在HBV感染的肝纤维化中起到启动子作用,这与朱 [26] 和郑 [27] 的研究成果相符合,同时Circ_MTM1的下调显著降低了HBV感染标志物的水平。最终,Circ_MTM1基因敲低显著抑制了PCNA、MMP2、α-SMA和COL1A1在HBV相关肝纤维化细胞中的表达。
5. 结论
综上所述,Circ_MTM1在HBV相关的肝纤维化组织和细胞中高度表达,Circ_MTM1通过调节肝纤维化相关蛋白的水平,在HBV相关肝纤维化进程中起到启动子作用,Circ_MTM1可能是临床HBV相关肝纤维化诊断和治疗重要的生物标志物,后续试验仍有待进一步开展。
基金项目
辽宁省大学生创新创业项目(X202210160026)。