1. 引言
随着全球人口不断增加,预估2050年人口数将到达100亿,世界各国对于粮食的需求亦与日俱增 [1] 。同时,全球的粮食供应也面临着气候变迁、土地破坏、水资源短缺等问题的威胁,调查指出目前全球仍有约24亿人处于粮食不安全的状况 [2] ,因此对现今粮食系统的改革已迫在眉睫。目前在全世界的人为温室气体排放量中,畜牧业就占了14.5%的比例,资料亦指出全球有约30%的土地以及16%的淡水资源投注于畜牧业,并且有约1/3的粮食产量用于养活牲畜,显示畜牧生产给地球上有限的水资源、土地资源及粮食资源带来沉重的压力 [3] 。一份出自于联合国政府间气候变迁专门委员会(Intergovernmental Panel on Climate Change, IPCC)的报告指出,减少肉类消费、改用其他植物来源等替代性饮食,将成为缓解及适应气候变迁的关键 [4] 。另一方面,拥有高消费水平的先进国家虽不易发生营养不良相关问题,但人民基于对身体健康及环境保护意识的追求,非动物性来源的替代性蛋白食品产业的发展亦渐受瞩目 [5] 。
目前替代性蛋白市场上,以植物基来源的原料大宗,其中大豆蛋白由于拥有良好的营养价值以及低成本的优势,成为最常被使用的替代性蛋白原料。大豆蛋白相关加工技术发展多年,虽已渐趋成熟,但由于大豆蛋白缺乏纤维质地,为求能建构与传统肉类相似的纤维口感,仍必须仰赖挤压加工技术及淀粉、纤维等辅料的添加,而大豆本身带有的豆腥味,亦成为相关仿肉产品开发的一大瓶颈 [6] 。另外,大豆等植物基来源原料属于农产品,仍会面临到气候变迁、种植土地不足等考验 [7] ,因此,寻求大豆蛋白等植物基来源以外的新颖性替代蛋白来源成为重要课题 [8] 。
生物技术的应用被认为是解决粮食问题的重要手段,相对于传统畜牧业或农业,透过生物反应器培养微生物来生产食物可大幅降低土地占用面积、水足迹和碳排放量,真菌蛋白的培养生产即为其应用例之一 [9] 。目前市面上已有超过8家企业销售真菌蛋白相关产品,其中以英国的真菌肉品牌投入最早,于1985年即以Fusarium venenatum菌丝体培养真菌蛋白作为替代肉产品上市,至今开发近600种成品,在全球17个国家地区皆有销售,显示F. venenatum为目前市场接受度相对较高的真菌蛋白来源 [10] [11] 。先前临床研究指出,摄取F. venenatum培养之真菌蛋白可帮助降低血中总胆固醇及改善血糖代谢 [12] ,然而其作用机制尚不明确。过去动物实验结果发现,给予高脂饮食小鼠灵芝菌丝体萃取多醣可明显降低肥胖小鼠的体重、血脂和体脂肪,肠道菌群亦出现明显分群差异 [13] 。另一研究发现,将给予中华被毛胞菌丝体的高脂饮食小鼠的肠道菌群,移植入另一高脂饮食小鼠可显著改善其肥胖相关特征 [14] ,显示真菌菌丝体的摄取可能透过改变肠道菌群,而近一步影响其他生理代谢。因此本研究使用高脂饮食喂食小鼠来探讨给予F. venenatum菌丝体培养之真菌蛋白对于体重、体脂肪及肠道菌群的影响,期望可进一步厘清真菌蛋白相关作用机制。
2. 材料与方法
2.1. 实验样品来源与制备
真菌蛋白之培养菌株Fusarium venenatum ATCC 20334购自美国细胞培养物收藏中心(American Type Culture Collection, ATCC),并取得商业授权。将F. venenatum ATCC 20334以vogel培养基 [15] 培养于5顿吨发酵槽中,经3天28℃培养后,离心去除上清夜后取得菌丝体,并进一步冷冻干燥成真菌蛋白粉(蛋白质含量:49.3%、脂肪含量:6.9%、碳水化合物含量:33.8%)。大豆分离蛋白购自益芳股份有限公司(蛋白质含量:90%、脂肪含量:0.5%、碳水化合物含量:1.8%)。
2.2. 试验动物
8周龄C57BL/6雄性小鼠购自实验动物中心(Laboratory Animal Center),每只体重约24公克。动物房温度控制22℃ ± 2℃,湿度控制55% ± 15%,光照与黑暗各12小时。本试验经实验动物照护及使用委员会(Institutional Animal Care and Use Committee, IACUC)审查同意,取得核准编号111-14ah。
2.3. 试验设计
C57BL/6小鼠经8天适应期后,随机分成负对照组(NC)、真菌蛋白组(FM)及正对照之大豆蛋白组(SP),每组8只,连续喂食8周高脂饮食实验饲料(54%热量来自于脂肪)。负对照组饲料的蛋白质来源为酪蛋白,其他两组则分别以真菌蛋白、大豆分离蛋白依据其蛋白质含量进行取代,实验样品蛋白质含量差异部分以玉米淀粉补足,三组饲料的热量分别介于508~512 Kcal/100g之间。各组试验小鼠皆采任食之方式进行饲育。试验期间每周测量并记录所有动物体重及饲料摄食量。试验第8周禁食16小时后使用二氧化碳将所有小鼠进行牺牲,并记录其最终体重。
2.4. 脂肪组织重量测定
小鼠牺牲解剖后,取出脂肪组织(副睾脂肪、肾脏周围脂肪及皮下脂肪重量),利用生理食盐水清洗并擦拭干净,量测并记录各个脂肪组织重量,以小鼠最终体重计算出各个脂肪组织的相对重量,计算公式如下:
2.5. 血清生化参数分析
小鼠牺牲后以心脏采血方式采集血液样本,样本经离心(10,000 rpm,4℃,10分钟)分离出血清,进行下列项目之检测:天门冬胺酸转胺酶(glutamic oxaloacetic transaminase, GOT)、丙胺酸转胺酶(glutamic pyruvic transaminase, GPT)、三酸甘油酯(triglyceride, TG)、总胆固醇(total cholesterol)及血中尿素氮(blood urea nitrogen, BUN)。
2.6. 肠道菌群16S rRNA基因高通量测序
试验第8周采集小鼠粪便,保存于−80℃冰箱。自每组8个样本中随机取5个小鼠粪便样本,使用MagCore® HF16 自动核酸提取仪(RBC Bioscience Corporation, Taipei)和MagCore®基因组DNA组织试剂盒(试剂盒代码401)从小鼠粪便中提取DNA后,采用引物5’-TTTCTGTTGGTGCTGATATTGCAGRGTTYGATYMTGGCTCAG-3’和5’-ACTTGCCTGTCGCTCTATCTTCCGGYTACCTTGTTACGACTT-3’扩增16S rRNA基因。扩增后产物使用Oxford NanoporeGridION测序仪进行全长16S rRNA测序分析。本次测序由康健基因股份有限公司(Health Genetech Corporation, Taoyuan)完成。取得之数据使用线上工具LEfSe (https://github.com/SegataLab/lefse)进行分析,采取Kruskal-Wallis检验及线性判别分析分析法(LDA)来评估两组之间各物种的丰度差异是否显著,以p > 0.05及|LDA score| < 2作为截止点。
2.7. 统计分析
实验结果以平均值(mean) ± 平均标准偏差误差(standard error of the mean, SEM)表示,试验数据利用SPSS统计软体中单因子变异数分析(One-Way ANOVA)后以Duncan’s multiple range test分析各组别间数据之差异性,并以p值小于0.05作为显著差异。
3. 结果
3.1. 不同蛋白质来源对高脂饮食摄取小鼠体重变化之影响
图1为试验期间每周小鼠的体重变化。试验开始时第0~2周各组间体重变化无显著差异。真菌蛋白组小鼠的体重从第3周起皆显著低于负对照组,第8周的体重亦明显低于大豆蛋白组(p < 0.05)。大豆蛋白组小鼠体重于试验第4、5及8周显著低于负对照组(p < 0.05)。于8周试验期间,三组小鼠的摄食量皆无出现明显差异(p > 0.05)。
3.2. 不同蛋白质来源对高脂饮食摄取小鼠血清参数之影响
表1为试验第8周的小鼠血清生化参数分析结果。检测小鼠血清肝功能指标GOT与GPT,三组之间没有出现明显差异(p > 0.05)。肾功能指标BUN分析结果显示,真菌蛋白组与其他两组之间无显著差异(p > 0.05),大豆蛋白组的BUN显著低于负对照组(p < 0.05)。血脂指标分析结果显示,真菌蛋白组小鼠的血清三酸甘油酯含量显著低于负对照组(p < 0.05),而总胆固醇含量在各组之间则无出现明显差异(p > 0.05)。
3.3. 不同蛋白质来源对高脂饮食摄取小鼠脂肪重量之影响
各实验组小鼠牺牲后,取下皮下脂肪以及代表内脏脂肪的肾周围脂肪和副睾脂肪组织,分别称量其重量后,以小鼠牺牲前的最终体重进行校正,计算出小鼠的脂肪组织相对重量。结果如图2所示,真菌蛋白组小鼠的副睾脂肪、肾周围脂肪及皮下脂肪组织相对重量皆显著低于负对照组(p < 0.05)。与负对照
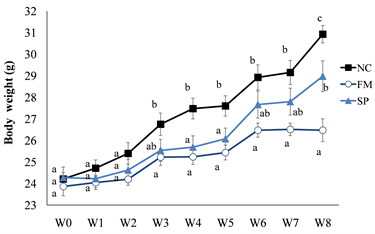 The values are the mean ± SEM (n = 8). Different letters indicate statistically significant differences (p < 0.05), NC: negative control, FM: mycoprotein, SP: soy protein.
The values are the mean ± SEM (n = 8). Different letters indicate statistically significant differences (p < 0.05), NC: negative control, FM: mycoprotein, SP: soy protein.
Figure 1. Changes of the body weight in high-fat diet-fed mice
图1. 高脂饮食喂食小鼠之体重变化

Table 1. Effects of different protein source on serum parameters in high-fat diet-fed mice
表1. 不同蛋白质来源对高脂饮食摄取小鼠之血清参数之影响
The values are the mean ±SEM (n = 8). Different letters indicate statistically significant differences (p < 0.05), NC: negative control, FM: mycoprotein, SP: soy protein.
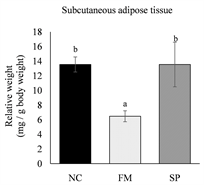
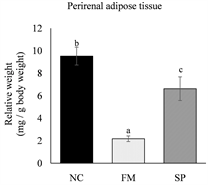
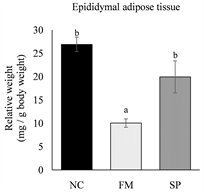 The values are the mean ± SEM (n = 8). Different letters indicate statistically significant differences (p < 0.05), NC: negative control, FM: mycoprotein, SP: soy protein.
The values are the mean ± SEM (n = 8). Different letters indicate statistically significant differences (p < 0.05), NC: negative control, FM: mycoprotein, SP: soy protein.
Figure 2. Effects of different protein source on the weights of adipose tissue in high-fat diet-fed mice
图2. 不同蛋白质来源对高脂饮食摄取小鼠之脂肪组织重量之影响
组相比,大豆蛋白组小鼠的肾周围脂肪组织相对重量明显较低(p < 0.05),副睾脂肪及皮下脂肪组织重量则无显著差异(p > 0.05)。
3.4. 不同蛋白质来源对高脂饮食摄取小鼠肠道菌群之影响
通过LEfSe分析(设置LDA > 2)找到各组之间具有显著差异的细菌群类。由图3(a)看出,真菌蛋白组和负对照组有23种物种表现出差异,其中Acetatifactor属、Roseburia属、Eubacterium在真菌蛋白组富集,Clostridium cocleatum、Adlercreutzia属、Lachnospiraceae属、Akkermansia属在负对照组富集。图3(b)结果显示,大豆蛋白组和负对照组有12种物种表现出差异,其中在属水平下,Lachnospiraceae、Romboutsia、Acetatifactor在大豆蛋白组富集,Clostridium cocleatum、Limosilactobacillus、Erysipelatoclostridium在负对照组富集。
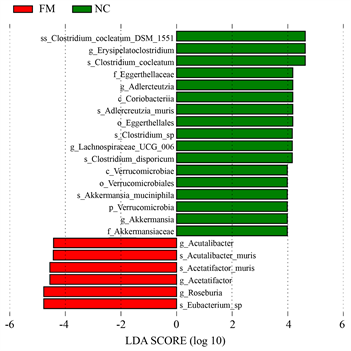 (a)
(a) (b)
(b)
Figure 3. LDA value distribution histogram of the gut microbiota in high-fat diet-fed mice. (a) Different species between mycoprotein group and negative control group; (b) Different species between negative control group and soy protein group
图3. 高脂饮食摄取小鼠肠道菌群之LDA值分布柱状图。(a) 真菌蛋白组和负对照组的差异菌;(b) 大豆蛋白组和负对照组的差异菌
4. 讨论
研究显示当C57BL/6小鼠自由摄取高脂饮食时,C57BL/6小鼠相对于其他品系的小鼠更容易出现肥胖、高胰岛素血症、高血糖等代谢异常问题 [16] ,C57BL/6小鼠的肠道菌群亦会随着饮食中脂质含量的增加而改变 [17] ,因此C57BL/6小鼠被认为是探讨饮食诱导肥胖所产生相关代谢紊乱问题以及肠道菌群变化的一种良好动物模型。本试验中给予C57BL/6小鼠含有真菌蛋白或大豆蛋白的高脂饮食,与摄取酪蛋白来源高脂饮食的负对照组相比,发现皆可明显减缓小鼠体重的增加,其中以真菌蛋白组的效果更为显著。由于三组之间的摄食量没有出现显着差异,显示真菌蛋白和大豆蛋白对于高脂饮食小鼠的体重维持效果,并非受摄食量差异的影响。血清生化参数分析部分,肝功能指标GOT、GPT在三组之间没有出现明显差异。肾功能指标BUN在真菌蛋白组和负对照组小鼠之间无显著差异,大豆蛋白组小鼠的BUN则显著低于负对照组。参考Jackson lab实验数据,16周龄C57BL/6雄性小鼠的BUN正常范围为21~29 mg/dL [18] ,因此虽然大豆蛋白组小鼠的BUN数值有降低,但仍落于正常范围内,显示真菌蛋白和大豆蛋白对于高脂饮食摄取小鼠的肝、肾功能皆无不良影响。
本次实验菌群分析结果显示,负对照组Clostridium cocleatum的丰度相较于其他两组较高。先前研究指出,Clostridium属(Clostridium cocleatum及Clostridium ramosum)与肥胖具正向相关性,Clostridium cocleatum与体重、脂肪重量、脂肪细胞大小以及血糖代谢呈现密切相关 [19] 。负对照组毛螺菌属(Lachnospiraceae)的丰度高于真菌蛋白组,研究发现毛螺菌属在肥胖和高血糖的人类和小鼠中高度定植,会产生反油酸等长链脂肪酸,从而促进饮食诱发的肥胖 [20] 。Acetatifactor属(Acetatifactormuris)在饮食诱导肥胖小鼠的肠道中高度表现,与肥胖的进展呈现正相关 [21] 。真菌蛋白组与大豆蛋白组小鼠Acetatifactor属的丰度皆高于负对照组,然而两组相对于负对照组小鼠在体重及体脂肪增加等肥胖表征上都呈现明显抑制,在肠道菌群方面则未能与先前研究观察到的变化完全一致。
在血脂分析部分,真菌蛋白组小鼠的血中三酸甘油酯显着低于其他两组。一份体外研究结果显示,F. venenatum发酵由来的真菌蛋白在模拟小肠消化过程的环境下,可以透过与胆盐结合来减少脂肪分解,可能进而影响血脂的代谢 [22] 。本次实验中真菌蛋白组小鼠的内脏脂肪及皮下脂肪皆显著低于负对照组,而大豆蛋白组小鼠相较于负对照组,仅在肾周围脂肪组织重量有明显降低,在副睾脂肪和皮下脂肪组织重量皆只观察到下降趋势。真菌蛋白主要由F. venenatum菌丝体所组成,由于菌丝体具有细胞壁结构,富含几丁质等纤维成分。先前研究指出菌丝体纤维经肠道菌利用发酵后可产生醋酸、丙酸、丁酸等短链脂肪酸 [23] 。短链脂肪酸已被证实可以透过促进脂肪酸氧化、增加热量产生以及抑制脂肪酸合成等机制来调节脂质代谢 [24] [25] 。故推测真菌蛋白缓解高脂饮食诱导血脂及体脂肪增加的可能作用机制之一,为F. venenatum的菌丝纤维经肠道菌利用后产生短链脂肪酸,可进一步帮助生物体内脂质代谢。另外,Coelho等人的研究发现,受试者食用真菌蛋白来源饮食7天即可观察到血中短链脂肪酸上升的趋势,而总胆固醇、低密度脂蛋白等脂质代谢相关参数与食用动物性来源蛋白饮食的受试者相比皆明显降低,相关实验结果亦可支持此论述 [26] 。然而本次实验并未进行短链脂肪酸相关分析,因此真菌蛋白的摄取对于高脂饮食诱发肥胖以及肠道菌群改变与脂质代谢之间的相互影响,仍有待后续研究探讨。
5. 结论
本试验利用高脂饮食摄取小鼠动物模式,探讨发酵来源的真菌蛋白以及传统植物来源的大豆蛋白两种替代性蛋白对于高脂饮食诱发之体重、体脂肪及肠道菌群变化的影响。经8周实验结果显示,摄取真菌蛋白可显著降低高脂饮食小鼠的体重、血清三酸甘油酯含量、内脏脂肪与皮下脂肪重量,且小鼠肠道Clostridium属、Lachnospiraceae属等肥胖相关菌群风度皆低于负对照组。摄取大豆蛋白可缓解小鼠体重的增加,并显著降低肾脏周边脂肪重量。综合以上试验结果,真菌蛋白及大豆蛋白对于高脂饮食摄取诱发之肥胖症状均具有改善效果,其中以真菌蛋白的改善效果更为显著,可成为替代性蛋白食品市场上具有健康诉求的潜力素材。
NOTES
*通讯作者。