1. 引言
中国是肉制品生产大国,生猪年屠宰量达2亿头以上,小肠等畜禽副产物资源极为丰富 [1] [2] 。但是,目前中国畜禽副产物的深加工利用率低 [3] [4] ,主要消费形式为食品。因此,开展猪肠黏膜等副产物附加产品的关键技术研究,充分利用畜禽副产物,提高畜禽副产物提取利用技术水平,提高畜产品加工副产物的附加值,对肉类加工企业都具有很好的应用前景。
肝素,也叫肝素钠,是一种抗凝剂,在临床上具有抗凝血、抗炎等作用。中国是肝素的主要出口国之一 [5] ,肝素的应用具有重要的经济价值。肝素是存在于动物肝脏,肺、胃、脾、肠黏膜等组织中 [6] ,以小肠黏膜、肺脏中含量最为丰富。肝素提取常用的方法有酶水解法 [7] [8] [9] [10] [11] 、超声波提取法 [12] 、盐析提取法 [13] [14] 等。其中,酶水解法以反应条件温和,得率高等优势得到广泛应用。因此,本文利用胰蛋白酶,对猪小肠黏膜进行水解,以黏膜酶解液效价为评价指标,对影响胰蛋白酶水解过程中的各种因素进行优化研究,确定合适的水解工艺条件,为酶法工业化生产肝素提供依据。
1.1. 主要原材料
猪小肠黏膜(购自于双汇泰威逊食品公司);木瓜蛋白酶(酶活力为20万U/g,购自于庞博生物工程有限公司);肝素钠标准品(USP Rockville, MD. LOT L11033);绵羊血浆(购自于山东苍山向明生化助剂厂);氢氧化钠、乙醇、氯化钠、氯化钙等均为分析纯,市售。
1.2. 主要仪器设备
所用主要仪器设备有UV power紫外可见分光光度计(北京莱伯泰科仪器有限公司),PHS
-3C
型实验室pH计(上海今迈仪器仪表公司),JJ-1精密增力电动搅拌器(金坛市科析仪器有限公司),GL
-21M
型高速冷冻离心机(长沙湘仪离心机仪器有限公司)。
1.3. 试验方法
1.3.1. 酶活力的测定
胰蛋白酶活力测定方法参考文献 [15] 的方法进行。
1.3.2. 小肠黏膜酶解
称取一定量的小肠黏膜,置入反应容器中,加入水,调节pH值,恒温水浴加热至反应温度,加入所需胰蛋白酶,记录时间,匀速搅拌,进行水解。水解结束后,采用85℃、10 min水浴处理。然后收集酶解液,测定肝素效价。若不能及时进行测定,密封保存于4℃条件下,备用。
1.3.3. 肝素效价的测定
肝素效价的测定,参考文献 [16] 的方法进行。
1.3.4. 试验设计
1) 单因素试验
主要考虑影响酶水解的常规因素(包括温度、时间、pH、酶底物浓度(酶质量与小肠黏膜质量的百分比)等进行单因素试验。考察指标为肝素效价。试验因素水平见表1。

Table 1. Single experimental factors and levels
表1. 单因素试验因素水平
2) 酶解条件优化
依据单因素试验结果,利用Box-Behnken设计,进行三因素三水平优化试验。
1.3.5. 数据分析
数据统计分析采用SPSS 18.0中的ONE-WAY ANOVA等程序进行。
2. 结果与分析
2.1. 时间对酶解液肝素效价的影响
图1是酶解时间对酶解液肝素效价的影响结果图。由图1可以看出,在水解时间1.5~3 h范围内,随着时间的延长,酶解液效价逐渐增大;水解3 h时达到最大,为6.65 U∙mg−1,而且显著高于其他各水平;在3~4.5 h范围内,酶解液效价显著降低。因此,在规定条件下,3 h是最佳水解时间。
2.2. 温度对酶解液肝素效价的影响
图2是温度对酶解液肝素效价的影响结果图。由图2可以看出,随着水解温度的升高,酶解液效价显著增大;55℃~60℃时酶解液效价达到7.68 U·mg−1,显著高于其他各水平;60℃以后,酶解液效价显著下降。因此,胰蛋白酶水解猪肠黏膜最佳酶解温度为60℃。
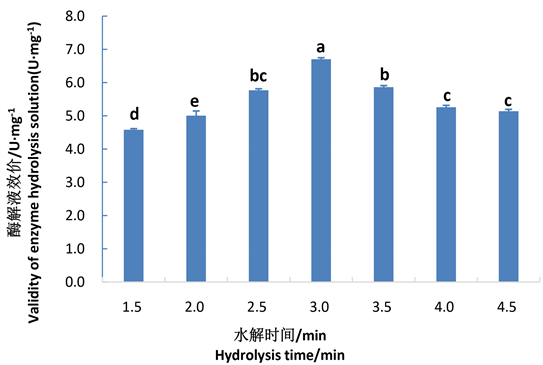
Figure 1. Effects of time on the validity of enzyme hydrolysis solution. Note: The different letters in the figure indicate the significant differences, P < 0.05. The same as below.
图1. 水解时间对酶解液效价的影响。注:图中不同字母表示差异显著,P < 0.05。下同。
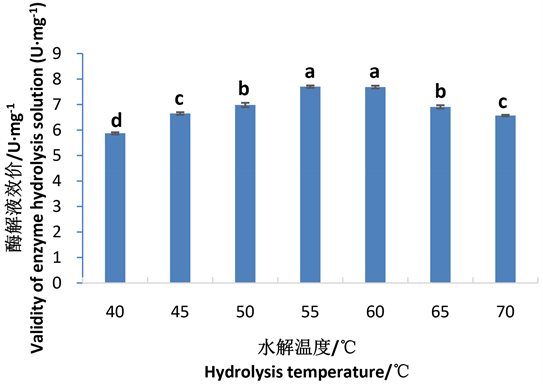
Figure 2. Effects of temperature on the enzymatic hydrolysate of potency
图2. 水解温度对酶解效价的影响
2.3. 酶底物浓度对酶解液肝素效价的影响
图3是酶底物浓度对酶解液肝素效价的影响结果图。
由图3可以看出,随着水解酶底物浓度的升高,酶解液效价显著增大;0.70%时酶解液效价达到9.46 U·mg−1,显著高于其他水平;0.70%以后,酶解液效价显著下降。因此,胰蛋白酶水解猪肠黏膜最佳底物浓度为0.70%。

Figure 3. Effects of substrate content on the enzymatic hydrolysate of potency
图3. 酶底物浓度对酶解效价的影响
2.4. 盐浓度对酶解液肝素效价的影响
图4是盐浓度对酶解液肝素效价的影响结果图。由图4可以看出,盐浓度为0.15~0.30 mol·L−1范围内,随着盐浓度的升高,酶解液效价显著增大;当盐浓度达0.30 mol·L−1时,酶解液效价达到8.84 U·mg−1,显著高于其他各水平;0.30 mol·L−1以后,酶解液效价显著下降。因此,胰蛋白酶水解猪肠黏膜最佳食盐浓度为0.30 mol·L−1。

Figure 4. Effects of salt concentration on the enzymatic hydrolysate of potency
图4. 盐浓度对酶解效价的影响
2.5. pH值对酶解液肝素效价的影响
图5是pH值对酶解液肝素效价的影响结果图。由图5可以看出,pH值7.0~8.5范围内,随着pH值的升高,酶解液效价显著增大;酶解溶液pH值8.5时酶解液效价达到7.85 U·mg−1,显著高于其他各pH水平;酶解溶液pH值8.5以上,酶解液效价显著下降。因此,选择最佳的料液pH值为8.5。

Figure 5. Effects of pH on the enzymatic hydrolysate of potency
图5. pH对酶解效价的影响
2.6. 料液比对酶解液肝素效价的影响
图6是料液比对酶解液肝素效价的影响结果图。由图6可以看出,随着料液比的降低,酶解液效价显著增大;料液比1:7 g·L−1时,酶解液效价达到8.15 U·mg−1,显著高于其他水平;料液比比1:7 g·L−1以后,酶解液效价呈下降趋势。因此,选择最佳的料液比为1:7 g·L−1。

Figure 6. Effects of material liquid ratio on the enzymatic hydrolysate of potency
图6. 料液比对酶解效价的影响
2.7. 响应面优化及结果
依据胰蛋白酶酶解猪肠黏膜单因素试验结果,利用Box-Behnken设计,进行三因素(水解温度、时间、酶底物浓度)三水平响应面优化试验,试验因素及水平编码见表2,试验结果见表3。
根据响应面统计方法对试验结果进行拟合,得出酶解液效价和底物浓度、水解时间,水解温度的拟合方程:

Table 2. Code and level of factors chosen for the experiments
表2. 试验因素水平及编码

Table 3. The results of the response surface tests
表3. 响应面试验结果
同时,对回归模型进行方差分析,结果见表4。从表4可以看出,回归模型具有高度的显著性(P < 0.0001),失拟项在α = 0.05水平上不显著(P = 0.0722 > 0.05),说明回归方程与实际情况吻合的较好,误差小,因此可用该回归方程代替试验真实点对试验结果进行分析。
由表4可知,该模型极显著,该模型能很好地解释数据差异性。其中酶底物浓度、水解时间,对肝素提取的影响表现为极显著。另外,该模型的确定系数为0.9988,调整确定系数为0.9973,说明该回归模型对数据的拟合程度较好,适于对肝素提取进行分析及预测。该模型的失拟项为0.0060,表现为不显著,因此该模型稳定性较好,能很好预测各因素对响应值的影响。
2.8. 响应面分析
响应面图形是响应值对应于试验因素所构成的可以反映各因素及因素间的交互作用对响应值的影响。将一个因素固定在零水平,可以作出两因素交互作用的响应曲面图和等高线图。等高线越圆,说明它们之间相互作用对肝素提取的影响越小;而等高线越接近椭圆,表示因素之间的相互影响越大。图7~9是酶底物浓度、酶解温度、酶解时间对应的酶解液肝素效价构成的三维空间曲面图。从结果可以看出,酶底物浓度和水解时间交互作用对酶解液肝素效价影响最小。

Table 4. The variance analysis results of regression models
表4. 回归模型方差分析结果
R = 0.9988;
= 0.9973
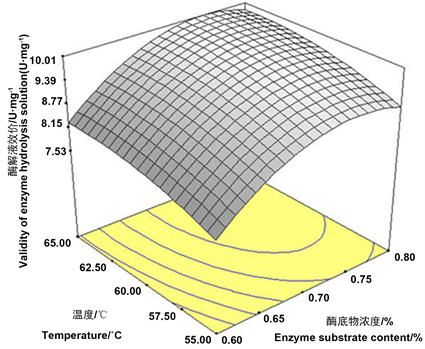
Figure 7. Effects of enzyme substrate ratio and temperature on the enzymatic hydrolysate of potency
图7. 酶底浓度和温度对酶解液效价的影响
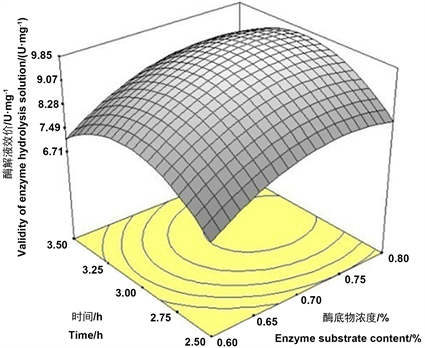
Figure 8. Effects of enzyme substrate ratio and time on the enzymatic hydrolysate of potency
图8. 酶底物比和时间对酶解液效价的影响

Figure 9. Effects of temperature and time on the enzymatic hydrolysate of potency
图9. 温度和时间对酶解液效价的影响
2.9. 验证试验
利用回归方程,在优化条件下,对酶底物比、水解温度、水解时间对应的酶解液效价进行预测和实际测定。结果见表5,预测值与真实值之间具有95.2%的相关性,可以利用上述回归方程对胰蛋白酶水解肠黏膜过程进行预测和控制。
同时,选择表5中编号为“1”的参数进行中试试验,中试结果与预测结果基本一致。因此,胰蛋白酶水解猪肠黏膜最适条件为:温度
60 ℃
,时间3 h,酶底物比0.70%。

Table 5. The relation of predicted response values and practised values
表5. 响应优化值与真实值之间的关系
相关性R2 = 0.952; Correlation R2 = 0.952。
3. 结论
1) 肝素效价和酶底物质量分数(A)、水解时间(B),水解温度(C)之间的关系可以用下式表示:
2) 通过单因素试验获得了胰蛋白酶水解猪小肠黏膜最佳条件为:温度60℃,时间3 h,pH值为8.5,酶底物浓度为0.70%,盐浓度为0.3 mol·L−1,料液比为1:7。
3) 利用Design Expert的Prediction功能进行试验设计并进行验证,获得胰蛋白酶水解条件为:酶底物质量分数0.70%,温度60℃,时间3 h。
基金项目
河南省科技攻关计划项目(142102210442)。
参考文献