1. 引言
苯甲酸(Benzoic acid)又名安息香酸,是一种芳香酸类有机化合物,也是最简单的芳香酸,苯甲酸外观为白色针状或鳞片状结晶。微溶于水,溶于乙醇、甲醇、乙醚、氯仿、苯、甲苯等,苯甲酸以及苯甲酸钠作为一种防腐剂,抗微生物剂,可以有效的增加食品的保质时间,是目前世界上应用最广,使用量最大的食品添加剂之一,每年使用量约10万吨 [1],苯甲酸和苯甲酸钠在我们国家的GB2670-2014《食品安全国家标准食品添加剂使用标准》 [2] 中规定苯甲酸及其钠盐可作为防腐剂添加到食品中,而在黄酒发酵的过程中会有苯甲酸自然的产生,Leuthardt F [3] 解释了由微生物降解苯丙氨酸自然产生苯甲酸的过程,虽然苯甲酸和苯甲酸钠在食品中无处不在,但张旭伟等 [4] 发现过量的苯甲酸被人体吸收后会生成苯甲葡萄醛酸,有致癌的风险,不利于人体的健康,因此必须要对食品中的苯甲酸含量进行测定。
悬浮固项微萃取根据萃取剂与被萃取物之间“相似者相溶”的原则,基于萃取剂与样品之间的吸附溶解解吸平衡而建立起来的集萃取、浓缩功能于一体的技术,利用萃取剂熔点较高的优点,通过冷冻使萃取剂凝固,从而使萃取剂易与同被萃取物分离,常用的萃取剂有十一醇,十二醇,十六烷等,悬浮固项微萃取法能与原子吸收光谱,质谱,可见分光光度计等多种检测方法连用,陈梦轩等 [5],付傅等 [6] 发现悬浮固相微萃取方法有较高的富集倍数和回收率,且萃取相易于回收。悬浮固相微萃取较其他萃取方法具有萃取效率高,操作简单,样品用量小,有机试剂消耗少,富集效率高等优点。近年来悬浮固相微萃取广泛应用于重金属和农药残留等测定中,本实验借鉴了漂浮有机液滴固化分散液液微萃取(DLLME-SFO)技术,在低温下,将疏水性萃取剂由液态转化成固态,以降低萃取相分离收集的难度,进而提高萃取效率。
十二醇(Dodecanol),为白色固体或油状液体,又名:月桂醇,十二烷醇。不溶于水、甘油,溶于丙二醇、乙醇、苯等。密度比水小,具有低挥发性,无毒,熔点高等特点,目前广泛用于轻工、化工、冶金、医药等工业品。
本文将对使用悬浮固相微萃取的方法对黄酒中苯甲酸的提取工艺进行研究,目的是简化对黄酒中苯甲酸的提取过程,节省实验时间,为后续进行课程实验以及进行其他食品中苯甲酸的含量测定提供一种新的方法。
目前对黄酒中苯甲酸的含量测定的主要方法是液相色谱法 [7] 和汽相色谱法 [8],但上述方法存在前处理复杂,实验过程繁琐,整体实验比较费时,仪器成本比较高等不足。而悬浮固相微萃取物是一种新兴的样品前处理技术 [9] [10],Huang等 [11] 发现使用熔点接近室温、密度小于水且毒性低或无毒的溶剂作为萃取剂,样品经离心和冷冻后,固化的有机相漂浮在水面上,可被轻易取出,因而可以快速分离萃取剂和被萃取物,可以大大缩短分析时间。
2. 实验部分
2.1. 材料与仪器
材料:会稽山三年陈酿绍兴酒购自小卖部,苯甲酸钠购自武汉有机,十二醇(纯度 > 98%)购自麦克林,无水甲醇(分析纯)购自江苏强盛功能化学股份有限公司,氯化钠(分析纯)购自上海试四赫维化工有限公司。
仪器:DGG-9140A型电热恒温鼓风干燥箱上海森信实验仪器有限公司;ME204E电子分析天平梅特勒托利多仪器有限公司;GL-20G-II台式高速冷冻离心机上海安亭科学仪器厂;L6S紫外可见光分光光度计上海精密科学仪器有限公司;XW-80A涡旋混合器宁波新芝生物科技股份有限公司;KG16V20TI电冰箱西门子股份公司。
2.2. 实验步骤
2.2.1. 标准曲线的绘制
苯甲酸标准溶液的制备与标准曲线的绘制苯甲酸的标准曲线以苯甲酸钠为标准品,采用紫外分光光度法,以苯甲酸钠浓度为横坐标、吸光度值为纵坐标绘制标准曲线,称取烘干后的苯甲酸钠样品0.05 g与50 mL容量瓶中加甲醇定容到50 mL配成1 mg/mL的母液,将母液与4℃下放入冰箱避光保存,将母液稀释配制成0.2 μg/mL、0.4 μg/mL、1 μg/mL、2 μg/mL、10 μg/mL、20 μg/mL、40 μg/mL、60 μg/mL,在230 nm处进行吸光度测定。如图1所示,得到苯甲酸钠浓度ρ和吸光度值A的标准曲线线性回归方程为A = 0.0403 ρ + 0.1186,相关系数R2 = 0.9996,说明在0.2~60 μg/mL范围内,苯甲酸浓度与吸光度值呈良好的线性关系。
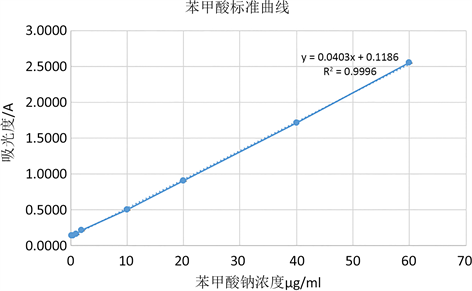
Figure 1. Standard curve of benzoic acid
图1. 苯甲酸标准曲线
2.2.2. 黄酒中苯甲酸的提取
为提取黄酒中的苯甲酸,设计了以下的提取方法,固定称取黄酒质量为2 g,置于10 mL离心管中,再称取一定量的氯化钠加到离心管中,混合溶解后再向其中加入一定量的十二醇,将离心管置于涡旋混合器中涡旋混合一段时间,然后用离心机将其离心,保证十二醇与黄酒可以分层,在7000 r/min离心10 min后取出,将离心完毕后的样品放入冰箱中静置冷冻10 min,使苯甲酸随着十二醇的凝固一并析出,用药匙取出凝固后的十二醇,等十二醇融化后,用甲醇稀释至5.5 mL,并在紫外分光光度计下用230 nm的波长测量其吸光度,将吸光度代入线性方程计算出萃取出苯甲酸的浓度。
2.2.3. 单因素实验
单因素试验分别考察了涡旋时间,十二醇加入量,盐加入量的质量分数对提取出黄酒中苯甲酸的含量的影响。
涡旋时间对提取出苯甲酸的含量的影响固定黄酒质量为2 g,在离心管中加入质量分数为0%的氯化钠,混匀后,加入十二醇500 μL,再对其进行涡旋混合,涡旋时间分别为0 s、30 s、60 s、90 s。考察不同的涡旋时间对提取出苯甲酸的含量的影响。
十二醇加入量对提取出苯甲酸的含量的影响固定涡旋时间为上述实验的最优值,其他条件不变,分别加入100 μL、200 μL、300 μL、400 μL、500 μL、600 μL、700 μL的十二醇,考察不同十二醇加入量对提取出苯甲酸的含量的影响。
盐加入量对提取出苯甲酸的含量的影响固定涡旋时间,十二醇加入量为上述实验的最优值,其他条件不变,分别加入质量分数为0%、5%、10%的氯化钠,考察不同盐加入量对提取出苯甲酸的含量的影响。
2.2.4. 响应面实验
响应面试验优化试验设计根据单因素实验结果,选取影响提取出苯甲酸的含量较大的涡旋时间,十二醇加入量,盐加入量的质量分数作为自变量,以提取出苯甲酸的含量为响应值,利用软件Design-Expert 8.0.6中Box-Behnken试验原理,设计3因素3水平的优化试验。因素及水平编码如表1所示。

Table 1. Design of response surface experiment
表1. 响应面实验设计
2.2.5. 提取出苯甲酸含量的计算
测定提取出苯甲酸的含量,按照上述方法进行吸光度测定,由线性方程计算出萃取出苯甲酸浓度之后,再通过公式1进行计算黄酒中的苯甲酸含量:
公式1:
,
X——试样中待测组分含量,单位为微克每毫克(μg/mg);
ρ——由标准曲线得出试样液中待测物的质量浓度,单位为微克每毫升(μg/mL);
V——试样定容体积,单位为毫升(mL);
m——试样质量,单位为克(g)。
3. 结果与分析
为得到最优的工艺条件,我们对使用悬浮固相微萃取的方法对十二醇萃取黄酒中苯甲酸流程中的关键步骤进行了单因素和响应面优化。
3.1. 单因素实验结果
3.1.1. 涡旋时间的单因素
涡旋时间对黄酒中苯甲酸含量的影响,由图2可知,随着涡旋时间的增加,萃取出的黄酒中苯甲酸的含量呈现先上升后下降的趋势,在涡旋时间为30 s时,萃取出苯甲酸的含量达到最大值,为0.1214 μg/mg。可能是因为涡旋时间越长,十二醇与黄酒越能充分混合,但继续延长涡旋时间时,可能导致溶液乳化过度,从而使含量有所下降 [12],因此最终选择涡旋时间为30 s为宜。
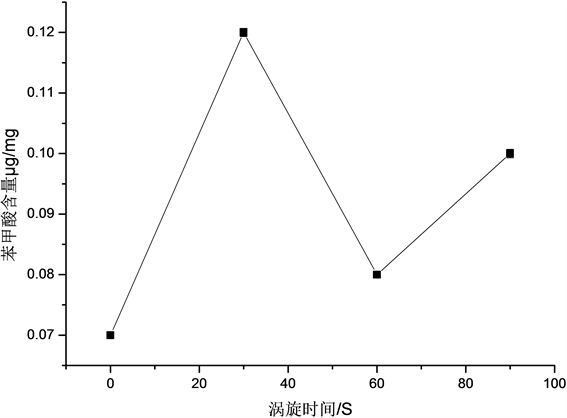
Figure 2. The influence of vortex time on the benzoic acid content in yellow rice wine
图2. 涡旋时间对黄酒中苯甲酸含量的影响
3.1.2. 十二醇加入量的单因素
十二醇加入量对黄酒中苯甲酸含量的影响,由图3可以看出,随着十二醇加入量的增加,萃取出的黄酒中苯甲酸的含量呈现先上升后下降的趋势,在十二醇加入量为500 μL时,萃取出苯甲酸的含量达到最大值,为0.1209 μg/mg。可能是因为随着十二醇加入量的增加,十二醇能够从黄酒中萃取出更多的苯甲酸,但继续加入十二醇时,十二醇的粘度增加,使得十二醇的空间位阻增大,反而不利于苯甲酸的萃取 [13],因此最终选择十二醇加入量500 μL最佳。
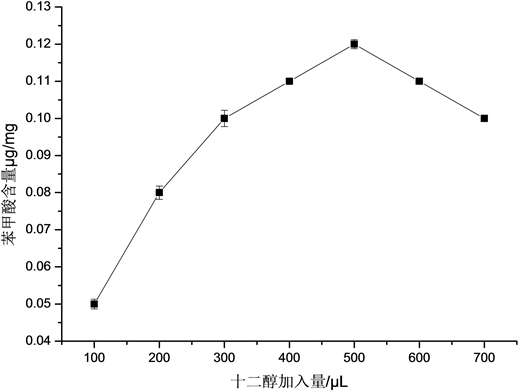
Figure 3. Effect of dodecanol addition on benzoic acid content in rice wine
图3. 十二醇加入量对黄酒中苯甲酸含量的影响
3.1.3. 盐加入量的单因素
盐加入量对黄酒中苯甲酸含量的影响,由图4可以得出,随着盐加入量的增加,萃取出的黄酒中苯甲酸的含量呈现先下降后上升的趋势,在盐加入量为0%时,萃取出苯甲酸含量最大值,为0.1200 μg/mg。可能是因为由于盐的加入,会使黄酒中的离子强度增加,从而显著增加溶液粘度增加了空间位阻 [14],阻碍了苯甲酸的萃取,而后续导致苯甲酸含量上升可能是因为,盐的加入降低了有机物在水相中的溶解度迫使更多的苯甲酸进入到有机相中,但是出于对实验成本的考虑我们最终还是选择以盐加入量为0%的时候最佳。
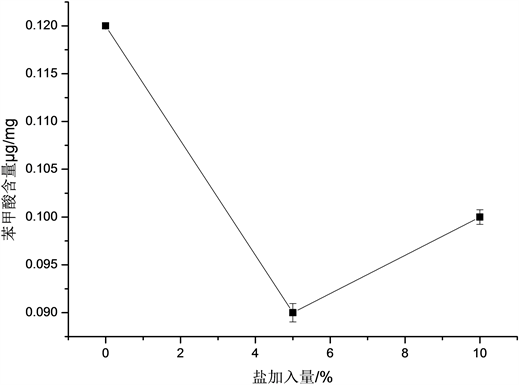
Figure 4. Effects of salt adding content on benzoic acid in yellow rice wine
图4. 盐加入量对黄酒中苯甲酸含量的影响
3.2. 响应面实验结果
响应面实验设计方案及结果分析,采用Box-Behnken响应面法对影响提取出苯甲酸的含量的涡旋时间,十二醇加入量,盐加入量的质量分数和超声时间优化的结果如表2所示。

Table 2. Results of response surface experiment
表2. 响应面实验结果

Table 3. Analysis of variance of response surface experiment results
表3. 响应面实验结果及方差分析
注:※表示差异显著(P < 0.1),※※表示差异极显著(P < 0.05)。
采用Design-Expert 8.0.6对提取出苯甲酸的含量进行数据分析可以得到各因素的回归拟合方程如下:
经Design-Expert 8.0.6软件ANOVA法分析响应表面二次多项式模型的显著性,实验方差结果分析如表3所示,由表3可知,模型中的B、A2、B2对提取出苯甲酸的含量的影响差异极显著(P < 0.05),BC、A、C、AB、AC、C2对提取出苯甲酸的含量的影响差异不显著(P > 0.1)。回归模型属于极显著水平(P < 0.05),失拟项极显著(P < 0.0001 < 0.05),试验复相关系数R2 = 0.9204和校正测定系数R2 adj = 0.8181,低变异系数C.V.% = 11.79%。以上结果均表明模型拟合程度高,可靠性强,观察值和实测值之间的相关性良好,可以对提取出苯甲酸的含量的结果进行分析和预测。根据回归方程和方差分析可知,各因素对提取出苯甲酸的含量的影响程度由大到小依次为B > C > A,即十二醇加入量 > 盐加入量 > 涡旋时间。
响应面法是一个通过分析自变量之间的相互作用以及自变量对响应值影响优化工艺的方法,是一种被广泛应用于食品加工中高产和产品质量验收的技术。涡旋时间、十二醇加入量、盐加入量之间相互作用的等高线图和响应面曲线图如图5ABC所示。Marco等人 [15] 发现,不同影响因素对响应面实验的结果的影响大小,可以通过观察等高线图和响应面图的陡峭程度来分析,等高线接近椭圆,曲面越陡峭,说明影响越显著。由图5ABC可以看出AC和BC之间的相互作用对得率的影响不大,等高线图近似于圆形,响应面图较为缓和;AB之间的相互作用对得率的影响大,等高线为椭圆形,同时响应面图较其他影响因素更为陡峭。
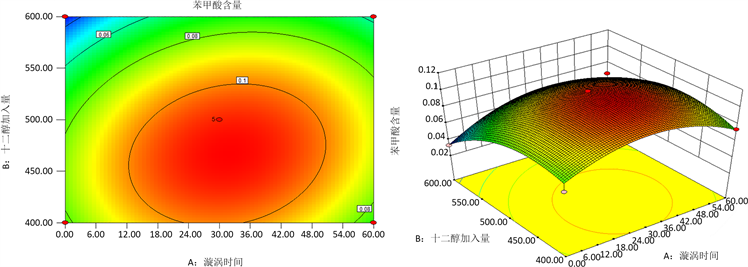 (a)
(a) 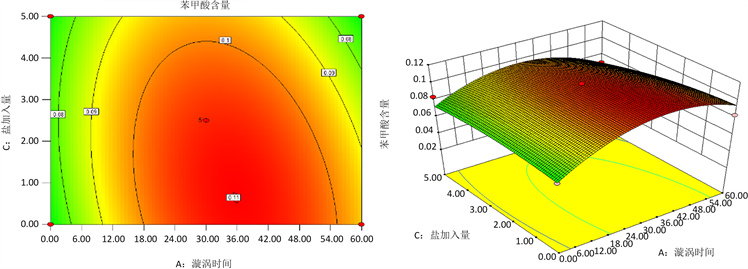 (b)
(b) 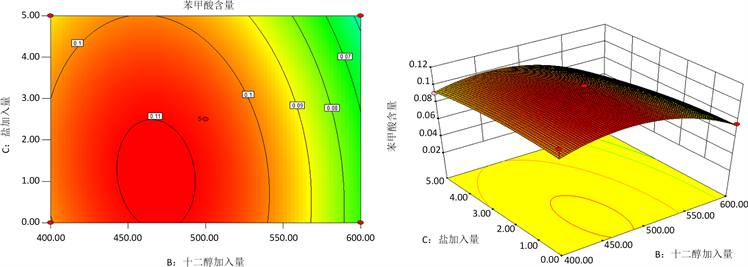 (c)
(c)
Figure 5. Surface plot of the influence of various factors on the response value: (a) The interaction between vortex time and dodecadiol addition amount; (b) The interaction between the vortex time and the salt addition amount; (c) Interaction between dodecol and salt additions
图5. 各因素对响应值影响的曲面图:(a) 涡旋时间与十二醇加入量之间的相互作用;(b) 涡旋时间和盐加入量之间的相互作用;(c) 十二醇加入量和盐加入量之间的相互作用
最佳工艺条件的预测及验证实验根据响应面模型预测最佳的悬浮固相微萃取紫外分光光度法测定黄酒中的苯甲酸的实验条件为:涡旋时间为34.05 s,十二醇加入量为470.69 μL,盐加入量为0.92%,理论提取出苯甲酸的含量得率为0.1118 μg/mg,为了验证预测值的准确性,同时兼顾操作的方便性,将最佳工艺条件调整为:涡旋时间为35 s,十二醇加入量为470 μL,盐加入量为1%,在此工艺条件下进行验证实验,重复试验3次,得到最后提取出苯甲酸的含量得率为0.1183 μg/mg,证实了预测值与实验值的之间的良好相关性,表明了该模型适用于黄酒中苯甲酸的提取。
4. 结论与讨论
本文研究了使用悬浮固相微萃取的方法在不同的工艺条件下对萃取出黄酒中苯甲酸的含量的影响,基于对工艺条件的单因素和响应面优化得到最佳工艺条件为:涡旋时间为35 s,十二醇加入量为470 μL,盐加入量为1%,在此工艺条件下提取出苯甲酸的含量得率为0.1183 μg/mg。与GB5009.28-2016 [4] 相比大幅缩短了实验所需的时间,简化了实验测定步骤,建立了一套对黄酒中苯甲酸提取的悬浮固相微萃取的前处理方法,采用十二醇作为悬浮固相微萃取的萃取剂避免了某些有毒试剂的使用,保证了实验人员的人身安全,提高了实验的安全性。由于使用的试剂较少,降低了分析成本,同时减少了对环境的污染。利用涡旋加速十二醇的分散和萃取;利用冷冻固化降低了萃取相分离收集的难度。在简化操作的同时,大大提高了提取效率,缩短了萃取时间。因此本方法具有较好的发展前景。