1. 引言
1.1. 工作记忆
工作记忆被描述为一种能力有限的系统,允许对理解、学习和推理等复杂任务所需的信息进行临时存储和操作(Miller, Galanter, & Pribram, 1961)。Baddeley和Hitch (1974)进一步证明了这一概念,提出工作记忆包括语音环路、视觉–空间画板和中央执行控制系统三个主要成分(Baddeley, 2003, 2007)。
在工作记忆中,直接反映工作记忆储存项目数量的成分是对侧延迟活动(contralateral delay activity, CDA),这是一种在工作记忆任务延迟期间观察到的持续ERP信号,与工作记忆能力的个体差异密切相关(Vogel and Machizawa, 2004; Vogel et al., 2005)。
1.2. 急性应激
1.2.1. 急性应激的定义及诱发
急性应激是指当不可预期和不可控制的环境要求超出了有机体的自然调节能力时,有机体作出的非特异性反应(Koolhaas et al., 2011)。本研究采用马斯特里赫特急性应激测试技术(Maastricht Acute Stress Test, MAST)来诱发应激,该范式是由Smeets和Cornelisse (2012)结合TSST的应激特点(社会评价性威胁,不可预测性或不可控性)和SECPT范式(生理疼痛成分),提出的由TSST中的心算任务和SECPT中的浸手任务交替联合操作的MAST范式。该范式包括5分钟的准备阶段和10分钟的应激阶段。被试需要在10分钟的时间跨度里完成5次SECPT和心算任务交替的试次(全程录像),每次持续时间60~90 s不等,水温保持2℃不变。单次SECPT之后进行心算任务(2043减17),时间由计算机控制(至少45 s)。被试计算错误接受负性反馈并重新开始。
1.2.2. 急性应激对工作记忆的影响受到抑制能力和刺激呈现方式的调节
在工作记忆的研究中,分心信息有时在工作记忆编码阶段呈现(与需要记忆的信息同时呈现),有时则在工作记忆保持阶段呈现,前一种叫编码分心,后一种叫延迟分心(McNab & Dolan, 2014)。工作记忆对两种不同呈现方式的分心信息的抑制可能具有不同的机制,编码分心信息的抑制与纹状体相关(Frank, Loughry, & O’Reilly, 2001; McNab & Dolan, 2014),延迟分心信息的抑制则与前额叶相关(Bonnefond & Jensen, 2012)。比如,对病人的研究显示(Cools et al., 2010),当分心信息通过编码分心呈现时,通过操控纹状体的受体活性使纹状体的功能增强,个体对分心信息的抑制能力提升了。这与之前发现的纹状体多巴胺在分心信息过滤中发挥作用的结果一致(McNab & Klingberg, 2008)。单细胞记录研究发现,当分心信息在保持阶段呈现时(即延迟分心),个体成功抑制分心信息会使前额叶中原本静息的神经元被额外的激活(Artchakov et al., 2009)。类似的,功能成像研究也发现背外侧前额叶参与到工作记忆对延迟分心信息的过滤(Dolcos et al., 2007; Minamoto, Osaka, & Osaka, 2010; Sakai, Rowe, & Passingham, 2002)。急性应激会导致包括多巴胺在内的多种激素的分泌,纹状体和前额叶的多巴胺受体分布不同,对多巴胺的反应也就不同(Arnsten et al., 2015)。因此急性应激对不同呈现方式下的分心信息抑制的影响可能不同。
1.3. 多体素模式分析
1.3.1. 多体素模式分析的原理
MVPA技术的核心原理是利用在不同认知状态下由多个体素信号形成的空间模式训练分类器,再用独立的实验数据测试分类器的性能。训练和测试分类器的过程称为模式分析,是机器学习理论中的重要技术,原本用于机器对模式进行识别(雷威等,2010)。
1.3.2. 解码方法在EEG数据中的应用
使用解码方法代替标准的单变量ERP幅度测量。传统方法考察共性当头皮分布因人而异时,被试的头皮模式会失去力量,而解码方法为每个被试找到最佳头皮模式,并且不受头皮地形个体差异的阻碍。解码方法旨在回答与标准方法不同的问题:与其询问具有已知含义的神经信号是否因组或条件而异,解码方法询问神经信号模式中存在多少信息,以及信息内容在不同条件或组之间有何不同(Hebart and Baker, 2018)。
Foster采用延迟估计任务和空间变化监测任务对EEG数据中的alpha波段活动进行解码,成功解码出工作记忆中项目的位置(Foster et al., 2016)。Haynes的研究对大脑活动的非侵入性测量,可以准确地解码一个人的意识体验。有助于揭示个人经历在人类大脑中的编码方式(Haynes & Rees, 2006)。Haxby使用功能性磁共振成像来研究人脑中物体视觉通路的功能结构,以测量当被试观看面孔、猫、五类人造物体和无意义的图片时腹侧颞叶皮层的反应模式,并对其解码分析从而在新的样本中可以推断出来他看到的是什么(Haxby et al., 2001)。Miyawaki通过使用MVPA对初级视觉皮层的解码,可以还原出来被试看到的图案(Miyawaki et al., 2008)。Bae等人采用颜色变化探测任务测量被试对侧延迟活动(CDA)波幅,从EEG信号中解码被试看到的哪一侧,预测被试要记住哪一面的能力(Bae et al., 2020)。
2. 材料和方法
2.1. 被试
本研究需要测量被试的唾液皮质醇浓度,为了避免女性的月经周期对皮质醇浓度造成影响,与绝大多数应激研究一样,本研究只选取健康成年男性被试。选择57名被试(根据(Shields et al., 2017)效应量为0.2),年龄18~35岁,参加实验时无生理、心理疾病,没有使用药物,参加实验前的1个月内没有使用类固醇之类的药物。被试分为2组,控制组31人,应激组26人。
2.2. 实验设计
本实验采用2 (组别:应激组,控制组) × 4 (记忆负荷:2、4、(2加2延迟)和(2加2延迟分心))混合实验设计,组别作为被试间变量,记忆负荷作为被试内变量。2、4、(2加2分心)和(2加2延迟分心)分别为同时编码2个目标刺激、同时编码4个目标刺激、延迟编码两个目标刺激、延迟编码2个分心刺激。
2.3. 实验材料
红色和蓝色矩形(1.21˚ × 0.64˚)。每个矩形总是以0˚,45˚,90˚或315˚的方向呈现。这些矩形呈现在两个虚拟矩形区域内,每个虚拟矩形内(4˚ × 7.6˚,距离固定点3˚)刺激的呈现方式有四种情况:同时呈现两个红色矩形,同时呈现四个红色矩形,先呈现两个红色矩形,再呈现两个红色矩形(延迟编码两个红色),先呈现两个红色矩形,再呈现两个蓝色矩形(延迟编码两个蓝色)。每个矩形之间的距离不小于2˚。在所有试验的中,有一半的试验会发生变化,其中一个红色的矩形的朝向可能会发生变化。
2.4. 实验任务
见图1,任务开始时在屏幕中央呈现一个箭头200 ms,被试需要记住箭头指向的方向,接着呈现“+”200~400 ms,之后出现的记忆阵列,被试需要记住刚才记住的箭头一侧的红色矩形阵列。接下来会出现两种情况:
1) 同时呈现两个目标刺激,或者同时呈现四个目标刺激100 ms,之后在相同位置会直接出现排列类似的矩形阵列(≤5000 ms),判断探测阵列与记忆阵列相比,是否发生了变化。
2) 先呈现两个目标刺激100 ms,接着500 ms的空屏之后出现100 ms的两个红色(目标刺激)或者两个蓝色(分心刺激),接着出现的矩形阵列与被试之前所看的所有矩形阵列(记忆阵列1和记忆阵列2)叠加后的阵列排列类似(≤5000 ms),其中只有一个红色矩形朝向可能会发生改变。任务保证按键反应及block顺序在被试间的平衡。
实验开始前被试会先进行60个trials的练习,每个条件做15个trials,以确保被试熟悉并且明白实验任务。实验总共分为8个block,每个block有80个trials,总共640个trials,每种条件下有160个trials。中间会休息7次。每次强制性休息一分钟,如果被试还没有休息好可以继续休息,但保证每次的休息时间不低于1分钟。
2.5. 研究工具
焦虑状态–特质量表(State-trait Anxiety Scale, STAL):由Spielberger于1977年编制,并于1983年修订的一种自我评价问卷。由两个分量表,40项描述题组成。21~40题是特质焦虑表(预实验用),用于评定人们经常的情绪体验。其中11项为负性情绪条目,9项为正性情绪条目。所有项目采用1~4分的4级评分法。其各级评分标准为:“1”表示几乎从来没有;“2”表示有时有;“3”表示经常有;“4”表示几乎总是如此。1~20题是状态焦虑量表(正式实验用),包含正性情绪和负性情绪各半,主要用于评定即刻或者最近的体验和感受。其各级评分标准为“1”表示完全没有;“2”表示有些;“3”表示中等程度;“4”表示非常明显。
正负性情绪量表(Positive and Negative Affect Scale, PANAS):是由美国南米得狄斯特大学及明尼苏达大学于1988年共同编制的,用于评定个体的正性和负性情绪。由20个反应情绪的形容词组成,包含了正性情绪因子和负性情绪因子。正性情绪由10个描述正性情绪的形容词组成,有较好的同质信度(p = 0.85)和重测信度(p = 0.47);负性情绪由10个描述负性情绪的形容词组成,有较好的同质信度(p = 0.83)和重测信度(p = 0.47)。
2.6. 实验流程
由于人体的皮质醇水平早晨清醒后最高,如果没有特殊情况发生,它会平稳的下降,在凌晨时分到达一天的最低值(杨娟,张庆林,2010)。因此,为了避免自身皮质醇节律对实验结果的影响,所有的实验都安排在下午1点至6点之间进行。实验前三天通过电话与被试联系,要求他们实验前72小时之内不喝酒,实验前24时之内不抽烟,实验当天不剧烈运动,实验前2小时内不进食。如图2,被试会有5次填写量表及皮质醇收集,完成整个实验时长在1~1.5小时左右。
2.7. 数据记录与分析
2.7.1. 脑电数据预处理
选用美国Neuro Scan公司生产的ESI-64导脑电记录分析系统,按照国际10~20的64导电极帽记录EEG。同时还记录双极水平及垂直眼电信号,采样的频率为1000 Hz,每个电极与头皮之间的阻抗均小于5 KΩ。采用Matlab (R2020a)、EEGLAB (V14.1.2) (Delorme & Makeig, 2004)、ERPLAB (v7.0.0) (Lopez-Calderon & Luck, 2014)和Matlab自定义代码对获得的EEG的数据进行离线分析处理。以左右乳突的平均值作为离线参考,对数据进行高通滤波(0.1 Hz, 24 dB/octave)和低通滤波(30 Hz, 48 dB/octave)。以记忆阵列(两个红色,四个红色,两个红色和两个蓝色)出现为标记,刺激呈现前200 ms和刺激呈现后1000 ms为时间窗,对连续数据进行分段,并选取刺激呈现前200 ms的脑电作为基线。对每个受试者的头皮脑电图进行独立成分分析(ICA),以识别和去除与眨眼(Jung et al., 2000)和眼球运动(Drisdelle et al., 2017)相关的成分。分别计算CDA幅值并去掉伪迹过多的被试,最终纳入分析的被试有54人(控制组:29人,应激组:25人)。
2.7.2. 问卷及皮质醇数据的记录及分析
采用SARSTEDT专门用于采集唾液的合成纤维唾液采集管采集唾液,采集后的唾液样本冷藏在零下20℃的冰箱中。采用电化学发光免疫分析法测定唾液皮质醇浓度。敏感性为1.5 nmol/L (下限)。对采集到的皮质醇数据,状态焦虑量表,积极、消极情感量表(PANAS)进行2 (组别:应激组,控制组) × 5 (时间点:第一次采集,第二次采集,第三次采集,第四次采集,第五次采集)的重复测量方差分析。
2.7.3. 行为数据的记录及分析
本研究采用Eprime呈现刺激并收集行为反应数据。采用公式K = N × (HR − FA)/(1 − FA)来计算被试的工作记忆容量。其中,K是工作记忆容量;N是呈现目标刺激的个数;HR是击中率,或者是出现变化时反应正确的比例;FA是误报率,或者是在没有变化的试次中反应错误的比例。再对被试的反应时、正确率和工作记忆容量进行2 (组别:应激组,控制组) × 4 (记忆负荷:同时呈现2个红色,同时呈现四个红色,延迟两个红色,延迟两个蓝色)的重复测量方差分析。
2.7.4. 解码精度分析
统计分析的因变量是每个被试在每个记忆负荷下的平均解码准确度。使用4 × 2 ANOVA分析这些值,记忆负荷(2、4、(2加2分心)和(2加2延迟分心))作为被试内因素,组别(应激组,控制组)作为被试间因素。进行单样本t检验,比较每个记忆负荷下应激组和控制组之间的解码精度。
2.8. 解码程序
使用支持向量机(SVM)和纠错输出代码(ECOC; Dietterich and Bakiri, 1995)的组合,根据64个头皮电极上的平均ERP活动的空间模式,对工作记忆中维持的显示器一侧(左与右)进行解码。ECOC模型通过组合多个二元分类器的结果来解决多类分类问题。对于每个被试,该过程分别针对三个记忆负荷中的每一个进行。来自给定记忆负荷的数据根据给定试验中哪一侧包含要记住的形状分为记住左和记住右试验。并使用3折交叉验证程序(Bae & Luck, 2019, 2018)。更具体地说,对于每次迭代,来自每个刺激侧的数据在每个单次试验时期的预定义时间点(600~900毫秒)内进行平均,然后随机分为三个大小相等的组,每组大约50次试验记忆负荷(由于排除了带有伪影的试验,这个数字因被试而异)。然后将每组中的试验平均在一起,为当前记忆负荷的每个刺激侧(4个平均值 × 2个刺激侧 × 64个电极的矩阵)产生单独的头皮分布。通过比较测试数据集中真正要记住的一面的标签和预测的一面的标签来计算解码精度。训练和测试是使用fitcecoc()和predict() Matlab函数。因为是二元分类,故两者概率均为0.5。
3. 结果
3.1. 唾液皮质醇结果
唾液时间点之间的主效应显著,F (4, 212) = 5.523,p < 0.001,η2 = 0.096,组别之间的主效应不显著,F (1, 53) = 1.207,p = 0.277,η2 = 0.023,组别和时间点之间的交互作用显著,F (4, 212) = 4.022,p = 0.004,η2 = 0.072。简单效应分析发现,控制组:时间点之间不存在显著差异,应激组:第二次测量和第三次测量存在边缘显著(p = 0.052),第二次测量和第四次测量存在显著差异(p < 0.001),第三次测量和第四次测量存在显著差异(p = 0.008)。
3.2. 问卷结果分析
3.2.1. 状态焦虑量表得分分析
状态焦虑问卷时间点之间的主效应显著,F (4, 212) = 19.629,p = 0.001,η2 = 0.274,随着时间的推移,两组被试的特质焦虑得分都越来越高。组别之间的主效应不显著,F (1, 53)=2.975,p = 0.091,η2 = 0.054。组别和时间点之间的交互作用显著,F (4, 212) = 4.735,p = 0.011,η2 = 0.060。简单效应发现:只有在第三次测量时,两组之间才存在显著差异(p = 0.002),应激组的得分显著高于控制组的。
3.2.2. 控制组和应激组正性情绪量表得分分析
正性情绪量表时间点之间的主效应显著,F (4, 212) = 26.398,p = 0.001,η2 = 0.337,时间越长,正性情绪量表的得分越低。组别之间的主效应显著,F (1, 53) = 4.676,p = 0.035,η2 = 0.082,控制组的正性情绪量表的得分高于应激组的。组别和时间点之间的交互作用不显著,F (4, 212) = 1.109,p = 0.353,η2 = 0.021。
3.2.3. 负性情绪量表得分分析
负性情绪量表时间点之间的主效应不显著,F (4, 212) = 1.577,p = 0.182,η2 = 0.029。组别之间的主效应不显著,F (1, 53) = 0.227,p = 0.636,η2 = 0.004。组别和时间点之间的交互作用不显著,F (4, 212) = 0.927,p = 0.449,η2 = 0.018。
3.3. 行为结果分析
3.3.1. 正确率分析
记忆负荷主效应显著,F (3, 159) = 143.316,p = 0.001,η2 = 0.757,记两个红色的正确率高于延迟两个蓝色,延迟两个蓝色的正确率高于同时四个红色,延迟两个红色的正确率是最低的。组别主效应不显著,F (1, 53) = 0.015,p = 0.904,η2 = 0。记忆负荷和组别之间交互作用不显著F (3, 159) = 0.495,p = 0.686,η2 = 0.009。具体见图3。
3.3.2. 反应时分析
记忆负荷主效应显著,F (3, 159) = 128.523,p = 0.001,η2 = 0.712,延迟两个红色的反应时高于延迟两个蓝色,延迟两个蓝色的反应时高于同时四个红色,同时两个红色的反应时是最低的。组别主效应显著,F (1, 53) = 4.964,p = 0.030,η2 = 0.087,应激组的反应时高于控制组。记忆负荷和组别之间交互作用显著F (3, 159) = 2.833,p = 0.040,η2 = 0.052。简单效应发现:在延迟两个红色和延迟两个蓝色条件下,两组之间差异显著(p = 0.046, p = 0.011)。具体见图4。
3.4. CDA的波幅值分析
在600_900的时间窗内:对应激组和控制组的CDA波幅值进行2 (组别:应激组,控制组) × 4 (记忆负荷:同时呈现两个红色,同时呈现四个红色,延迟两个红色,延迟两个蓝色)的重复测量方差分析。结果发现:记忆负荷主效应显著,F (3, 159) = 12.677,p < 0.001,η2 = 0.196,记忆四个红色的波幅值大于记忆两个红色,记忆两个红色大于延迟两个蓝色,记忆延迟两个红色的CDA的波幅值是最小的。组别主效应显著,F (1, 53) = 5.243,p = 0.026,η2 = 0.092,应激组的波幅值小于控制组的波幅值。记忆负荷和组别之间交互作用不显著,F (3, 159) = 0.355,p = 0.232,η2 = 0.027。具体见图5。
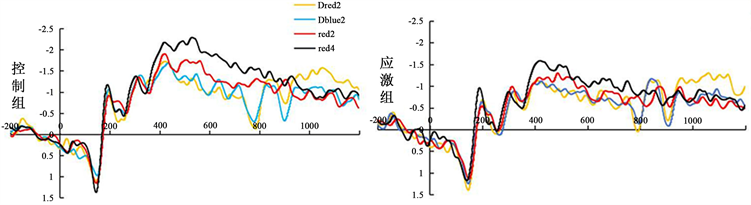
Figure 5. CDA amplitudes in each group (Dred2 and Dblue2 are two target stimuli with delayed encoding and two distracting stimuli with delayed encoding)
图5. 各组CDA波幅(Dred2和Dblue2为延迟编码两个目标刺激、延迟编码2个分心刺激)
3.5. 解码分析
图6显示了两组分别在4个记忆负荷下的平均解码精度。在所有负荷条件下控制组的解码正确率都大于应激组。使用单样本t检验分别对每个组的各个负荷条件下正确率是否显著高于0.5。结果显示,对于控制组的所有负荷而言,平均解码准确率都显著高于0.5 (同时编码2个目标:t (28) = 7.481, p < 0.001;同时编码4个目标:t (28) = 9.143, p < 0.001;延迟编码两个目标:t (28) = 5.211, p < 0.001;延迟编码2个分心目标:t (28) = 6.651, p < 0.001)。应激组也是如此(同时编码2个目标:t (24) = 7.314, p = 0.001;同时编码4个目标:t (24) = 9.865, p < 0.001;延迟编码两个目标:t (24) = 3.670, p = 0.001;延迟编码2个分心目标:t (24) = 4.811, p < 0.001)。

Figure 6. Decoding accuracy (2 + 2D and 2 + 2B are delayed encoding of two target stimuli and delayed encoding of two distracting stimuli)
图6. 解码正确率(2 + 2D和2 + 2B为延迟编码两个目标刺激、延迟编码2个分心刺激)
为了评估组别和记忆负荷之间的差异,进行4 × 2 ANOVA,其中记忆负荷()作为被试内因素,组别(控制、应激)作为被试间因素。组别的主效应显着(F (1, 53) = 10.38, p = 0.001, η2 = 0.48),记忆负荷的主效应显着(F (2, 106) = 3.294, p = 0.022, η2 = 0.45)。记忆负荷和组之间的交互作用不显着(F (2, 106) = 0.165, p = 0.92, η2 = 0.002)。
4. 讨论
本研究的目的是探讨急性应激对于工作记忆中不同呈现方式的信息的影响。因此,采用MAST范式作为应激诱发范式,以唾液皮质醇作为衡量应激是否有效的生理指标,以特质状态焦虑问卷(S-AL),正负性情绪量表(PANAS)作为应激是否有效的心理指标,变化探测范式作为研究范式,采用事件相关电位技术,结合多变量解码方法研究急性对于工作记忆中不同编码方式的信息及增加新项目的影响。
我们发现急性应激对于同时呈现的信息的储存会产生影响,应激组CDA的波幅都会小于控制组CDA的波幅。但是当开始呈现延迟信息后,发现两组被试之间,CDA的波幅值在同时呈现四个红色和同时呈现两个红色上有显著差异,而在延迟两个红色和延迟两个蓝色上,CDA的波幅值并没有显著差异,这说明应激会影响同时呈现方式的信息。应激都不会影响被试对于不同呈现方式的分心信息的过滤,因为在同时编码分心信息和延迟编码分心信息使用的是单独的过滤机制(McNab & Dolan, 2014)。工作记忆对两种不同呈现方式的分心信息的过滤可能具有不同的机制,编码分心信息的抑制与纹状体相关(Frank et al., 2001; McNab & Dolan, 2014),延迟分心信息的过滤则与前额叶相关(Bonnefond & Jensen, 2012)。而MAST范式产生的应激既不会影响纹状体,也不会影响前额叶,因此,对于分心信息的过滤都不会影响。从解码精度来看,四种刺激下的控制组精度均显著高于应激组,说明了急性应激会对工作记忆抑制不同呈现方式的分心信息有影响。
5. 结论
急性应激对于同时呈现的信息的储存会产生影响,应激组CDA的波幅都会小于控制组CDA的波幅。应激不会影响被试对于不同呈现方式的分心信息的过滤。