1. 引言
微生物生物合成的天然色素,具备丰富的色彩种类、独特的生物活性、生物相容性和对环境友好性,一些天然色素具有抗菌、抗肿瘤、抗氧化、抗衰老、降血脂等生物活性,同时具有高营养、高安全性的特性 [1] [2] 。红色素以红曲菌发酵生产研究居多,但红曲菌发酵能够产生一种真菌毒素——桔霉素(Citrinin),具有肝脏毒性和肾毒性;也产生一种食品工业中禁止添加的抗胆固醇药物——梅奴灵(Mevinolin),这些因素使红曲色素在实际应用中受到了极大的限制 [3] 。丝状真菌菌种资源丰富,其产色素的性能也得到不断挖掘利用。近年来,国内外研究报道产红色素的真菌主要有血红红曲菌(Monascus sanguineus) [4] 、产紫青霉(Penicillium purpurogenum)、草酸青霉(Penicillium oxalicum)、紫色红曲菌(Monascus purpureus)、拟分枝孢镰刀菌(Fusarium sporotrichioides)、偏侧蛇虫草菌(Ophiocordyceps unilateralis)、黑曲霉(Aspergillus niger) [3] [5] 、产紫篮状菌(Talaromyces purpurogenum) [6] 、白双轮篮状菌(Talaromyces albobiverticillius) [7] [8] 、暗玫瑰篮状菌(Talaromyces atroroseus) [9] 、萨氏曲霉(Aspergillus sydowii) [1] 和一种南极采样分离的地丝霉(Geomyces sp.) [10] 。
本研究分离产木质纤维素降解酶丝状真菌的过程中,分离纯化到一株产水溶性红色素的篮状菌,对菌株进行了形态学和分子生物学特性鉴定,红色素合成影响因素,红色素粗提液的稳定性、染色性展开研究,以期为红色素的开发利用提供科学依据和理论基础。
2. 材料与方法
2.1. 材料与仪器
菌种分离来源基质物:发霉的柚子皮。
羧甲基纤维素钠(CMC-Na,食品级,重庆力宏精细化工有限公司),Cd(NO3)2∙4H2O (AR,天津市科密欧化学试剂有限公司),无水乙醇,亚硫酸钠,双氧水,氯化钠,红曲色素。
全自动高压蒸汽灭菌器(登冠医疗),电热恒温鼓风干燥箱,立式恒温振荡器,洁净工作台,人工气候培养箱(上海一恒),高速冷冻离心机(卢湘仪),光学显微镜(Olympus),紫外可见光分光光度计。
产纤维素酶真菌分离培养基:以纤维素为唯一碳源。按察氏液体培养基配方 [11] ,用含1.5%羧甲基纤维素钠替代配方中的蔗糖,121℃,灭菌30 min。
马铃薯葡萄糖琼脂培养基(PDA)、察氏固体培养基、以及以察氏培养基为基础的培养基,均按配方配制 [11] ,121℃,灭菌30 min。
2.2. 实验方法
2.2.1. 菌株的分离与形态学的观察
制作产纤维素酶真菌分离培养基固体平板,用镊子夹取少量发霉的柚子皮壳样品,放置在平板中央,28℃培养7 d,生长出能产纤维素酶的丝状真菌菌落。待菌落产生孢子后,继续分离纯化,得到一株能利用纤维素生长产红色素的菌株RedF。
菌株斜面培养物孢子三点法接种到PDA培养基平板上,27℃培养7 d,跟踪观察菌落生长特征,观察显微镜下菌丝体的形态结构。
2.2.2. 镉离子对菌落形态建成的影响
将菌株RedF斜面孢子接种到Cd2+含量为10 mg/L的PDA培养基平板上,27℃培养7 d,观察菌落特征。将含镉平板上生长的菌落的孢子,再转接于普通PDA培养基平板,观察传代培养后生长菌落特征。比较分析菌株生长在含镉和无镉平板上菌落的大小、孢子的颜色、菌丝的发达程度、以及产生红色素量的差异性等。
2.2.3. 菌株的基因组多位点序列分型鉴定
将菌株RedF接种培养于PDA液体培养基,27℃振荡培养7 d,移取10 ml培养液,10000 rpm离心10 min,收集菌丝体沉淀物样品,寄送上海生工生物工程有限公司测序。测定rRNA基因的ID区、β-微管蛋白基因(BT2)、钙调素基因(CaM)和RNA多聚酶Ⅱ基因(RBP2)等4个保守基因的序列。
将所测定的4个序列分别在GenBank中进行BLAST搜索,根据BLAST结果初步判断菌株的种属类别。从GenBank中nucleotide数据库(https://www.ncbi.nlm.nih.gov/nuccore)中搜索下载青霉菌的有性型篮状菌属(Talaromyces)中Trachyspermi组的18个种的代表株菌(含模式菌株)的4个基因位点的序列(见表1),用作参考序列。对于ITS基因测序,通常采用通用引物为ITS1(5’-TCCGTAGGTGAACCTGCGG-3’)和ITS4(5’-TCCTCCGCTTATTGATATGC-3’)。因本次序列测定的ID区序列较长,测得序列中包含通用反向引物ITS4的反向互补保守序列(5’-GCATATCAATAAGCGGAGGA-3’),截去其下游序列而得到完整的ITS区序列用于后续比对分析。从GenBank数据库中下载的其它7个菌种如T. aerius,T. diversus,T. erythromellis,T. minioluteus,T. minnesotensis,T. purpureogenus和T. udagawae的基因序列都同样包括ITS4的反向互补保守序列,都对其下游序列截除处理,以保证用于比对的基因序列都是基于真正意义上的ITS区序列。
首先将19个菌株(除因只检索到3个基因的Talaromyces systylus外)的单个基因位点片段序列用ClustalW 1.83程序进行多序列比对生成等长的序列。四个位点都比对完毕后,将每一个菌株的4个基因位点合并成独立的序列片段,即ITS-BT2-CaM-RPB2,其长度为3281字符。以软件PAUP v4.0b10将合并后等长的19个多基因位点合并序列生成最简约系统发育树严格一致树(Strict consensus tree),自举值(Bootstrap Value)设定1000次,以菌株Talaromyces purpurogenus CBS 122434作外群。并用软件MrBayes 3.2.7计算一致树分支节点的贝叶斯后验概率(Bayesian Posterior Probabilities)。通过比较系统发育树上待测菌株RedF与已知模式株的系统发育关系,确定待测菌株的种名。

Table 1. Reference strains for phylogenetic analysis and accession number of four genes of each strain in GenBank
表1. 系统发育分析用的参考模式株及其四个基因在GenBank中的编号
2.2.4. 红色素粗提液最大吸收波长的确定
将菌株RedF斜面孢子接种于添加0.3% CMC-Na的察氏液体培养基中,27℃振荡培养7 d,10,000 rpm离心10 min,收集含红色素上清。向上清添加无水乙醇(色素液V1:无水乙醇V2 = 3:1),静置30 min沉淀其中细胞碎片、蛋白质、多糖和核酸等,离心后,置于80℃电热烘箱挥发掉乙醇组分得到红色素粗提液。以去离子水为参照物,进行紫外–可见光全波长扫描,测定红色素最大吸收波长。
2.2.5. 培养基中CMC-Na对红色素合成的影响
将菌株RedF斜面孢子分别接种到CMC-Na含量为0.05%、0.1%、0.2%、0.3%、0.4%的察氏液体培养基中,27℃振荡培养7 d,观察菌株产色素情况并在λmax处测定各处理粗提液的吸光度值。
2.2.6. 红色素的理化条件稳定性
检测温度、还原剂、氧化剂及盐度等因素对红色素稳定性的影响 [9] 。分别对色素粗提液进行以下操作:将红色素粗提液分别置于20℃、40℃、60℃、80℃和100℃下;配制含Na2SO3终浓度为0、0.002 g/L、0.02 g/L和0.05 g/L的红色素溶液;配制含H2O2浓度为0、0.03%、0.3%、1.5%和3%的红色素溶液;配制含NaCl浓度为0、3 g/L、6 g/L、10 g/L和40 g/L的红色素溶液。在室温下避光静置30 min后,在λ503处测定各处理的吸光度值,比较分析各处理下红色素的稳定性。
2.2.7. 蛋白质、淀粉染色性能试验
取加去离子水稀释100倍红曲色素溶液、色素粗提液,各两份分装40 mL和30 mL,测定两种色素溶液的吸光度(λmax = 503 nm)初始值;各加入4 g新鲜豆腐块(切成8块1 cm3正方体小块)于40 mL的色素溶液中,加0.3 g玉米淀粉于30 mL的色素溶液中,25℃浸泡静置0.5 h,经40 μm微孔滤膜过滤后,再测定染色后色素溶液的吸光度残余值,按照式(1)计算出其染色率D值 [12] 。式中D1为染色前色素液吸光值(初始值),D2为染色后的色素液吸光值(残余值)。
(1)
3. 结果与分析
3.1. 菌株的形态学观察
菌株RedF在PDA培养基上培养,其菌落形态及菌丝体的显微形态见图1 。菌落直径3 cm左右;菌丝体不发达,紧贴培养基表面不容易挑取;产深绿色分生孢子;菌落边缘菌丝白色,绒毛状;菌落向周围分泌红色水溶性色素。在显微镜下观察菌丝体结构,可见典型的特化为帚状枝样分生孢子头,帚状枝双轮生,孢子椭圆形,量大。这些特性与青霉属真菌的形态特性描述相符 [13] ,初步鉴定菌株为青霉属真菌。

Figure 1. Colony morphology of the strain growing on PDA and microscopic morphology of the mycelia
图1. PDA平板上生长的菌落形态及菌丝体显微形态图
3.2. 镉离子对菌落形态建成的影响

Figure 2. Colony morphology of the strain growing on PDA containing 10 mg/L of cadmium ion
图2. 含10 mg/L镉离子的PDA平板上生长的菌落形态
菌株RedF在含10 mg/L Cd2+的PDA平板上生长的菌落形态见图2,与图1的菌落形态有明显差别。在含Cd2+PDA平板上,菌丝长速迟缓,菌落直径约1.5 cm,表面中部较厚或中间有脐状突起,产生分生孢子呈粉红色,菌落边缘新生菌丝呈白色,菌落向周围分泌红色色素液,产生量相对较小。将含镉平板上的菌丝体和孢子再接种到不含镉PDA平板上,菌落生长状态会恢复到与图1一样的正常状态。表明镉离子对菌株RedF的菌落建成影响在遗传上是可逆转的。
3.3. 基因组多位点序列分型鉴定
序列测定得到rRNA基因中的ID区、BT2、CaM和RPB2四个保守基因的序列分别为1061 nt、510 nt、746 nt和1139 nt。将四个基因序列逐个分别在GenBank中进行BLAST搜索,结果共同指向暗玫瑰篮状菌(Talaromyces atroroseus)的一些菌株为唯一的最高同源性(>97%)的亲缘菌,可初步鉴定待测菌株RedF为暗玫瑰篮状菌。
四个保守基因基因位点序列合并后,利用PAUP软件最简约法(Maximum Parsimony, MP)和MrBayes软件贝叶斯推断法(Bayesian Inference, BI)构建的系统发育树具有相同的拓扑结构,生成的最简约(MP)系统发育树见图3。待测菌株RedF、篮状菌属(Talaromyces)中Trachyspermi组的17个种以及外群菌株T. purpurogenus的4基因合并序列建成系统发育树,显示待测菌株RedF与T. atroroseus聚类在同一支系,两者具有最近亲缘性。因此,鉴定待测菌株RedF是一株暗玫瑰篮状菌,命名为Talaromyces atroroseus RedF。
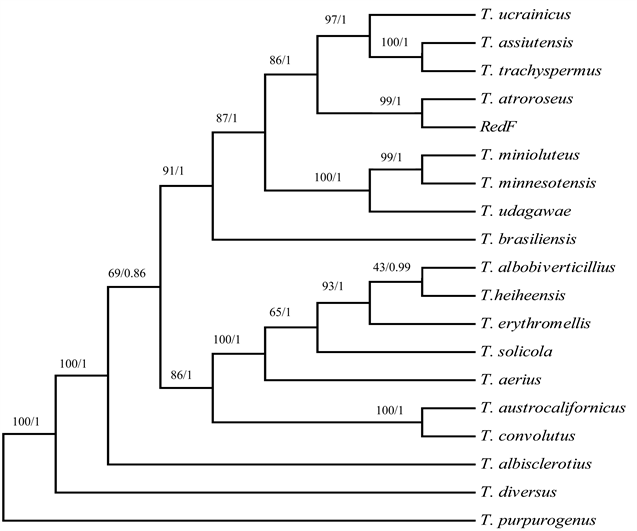 注:分枝节点显示自举值百分比(前/)和贝叶斯后验概率(/后),菌株Talaromyces purpurogenus CBS 122434作外群。
注:分枝节点显示自举值百分比(前/)和贝叶斯后验概率(/后),菌株Talaromyces purpurogenus CBS 122434作外群。
Figure 3. Maximum parsimonyphylo genetic tree constructed based on ITS-BT2-CaM-RBP2 gene loci sequences
图3. 基于ITS-BT2-CaM-RBP2四基因位点合并序列构建的最简约系统发育树
3.4. 红色素最大吸收波长的确定
对色素粗提液进行紫外–可见光全波长扫描,显示最大吸光度的吸收峰在503 nm。后续试验选取503 nm处波长测定红色素溶液的吸光度值(图4)。
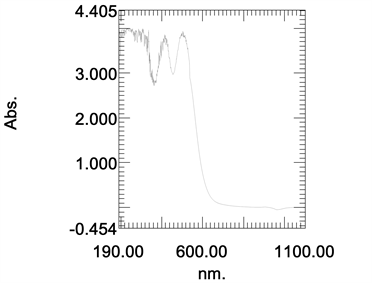
Figure 4. Diagram of the crude extraction solution of the red pigment scaned under wavelength range 190 to 1100 nm
图4. 红色素粗提液在190~1100 nm波长的扫描图
3.5. 培养基中CMC-Na对红色素合成的影响
不同浓度CMC-Na培养后的色素溶液和其吸光度值(OD503)见图5。培养液的颜色对比与吸光度值比较分析结果表明,在察氏培养基中添加CMC-Na会不同程度地影响菌株合成红色素的产量,当CMC-Na的含量为0.3%时,红色素的产量最高、吸光度值最大。

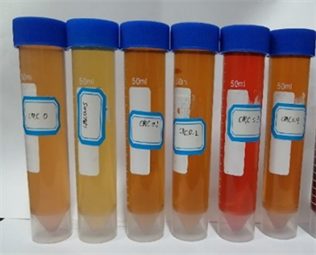 注:从左至右,CMC-Na含量依次为0,0.05%,0.1%,0.2%,0.3%和0.4%。
注:从左至右,CMC-Na含量依次为0,0.05%,0.1%,0.2%,0.3%和0.4%。
Figure 5. Diagram of the pigment solution under different concentration CMC-Na treatment and its absorption value
图5. 不同浓度CMC-Na处理后色素溶液和其吸光度值
3.6. 红色素的理化条件稳定性
温度、亚硫酸钠、双氧水、氯化钠对红色素稳定性影响依次见图6~9。图6显示红色素在20~60℃条件下较稳定。图7显示亚硫酸钠浓度低于0.002 g/L时,对色素有一定的增色效果,当亚硫酸钠浓度高于0.002 g/L时,亚硫酸钠的浓度对色素稳定性几乎无影响。图8显示随着H2O2浓度的增加,色素稳定性逐渐降低,表明H2O2对红色素的稳定性有负面影响,该红色素在含氧化剂的微环境下稳定性下降。图9显示随着NaCl浓度增加,红色素的稳定性下降,但在高浓度NaCl条件下仍保留较高的吸光度,具有染色应用潜力。
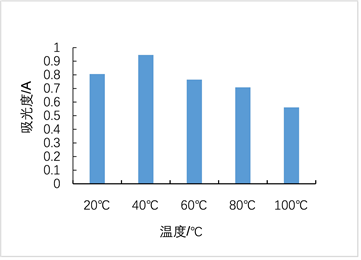
Figure 6. Diagram of the temperature effect on pigment solution stability
图6. 温度对红色素稳定性的影响
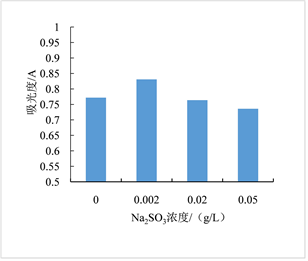
Figure 7. Diagram of the sodium sulphite effect on pigment solution stability
图7. 亚硫酸钠对红色素稳定性的影响
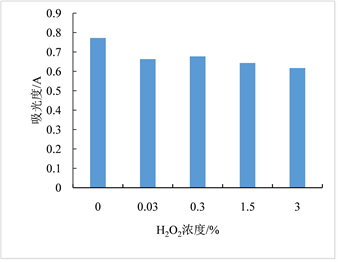
Figure 8. Diagram of the hydrogen peroxide effect on pigment solution stability
图8. 氧化剂H2O2对红色素稳定性的影响
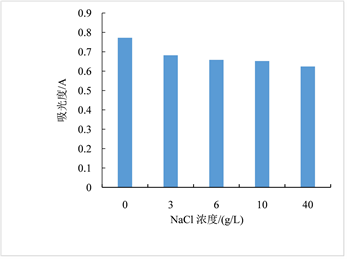
Figure 9. Diagram of the sodium chloride effect on pigment solution stability
图9. NaCl浓度对红色素稳定性的影响
3.7. 色素对蛋白质、淀粉染色性能
目测两种色素对豆腐块的染色效果一致(图10)。在λmax = 503 nm的波长下测得色素对蛋白质,淀粉染色前后吸光度值和着色率计算结果见表2。菌株产生的红色素粗提液对蛋白质类食材具有一定的染色能力,染着率为40.8%,略低于稀释100倍的红曲色素的染着率(57.1%)。红色素粗提液对淀粉粒的染色能力较差,其染着率与稀释100倍的红曲色素溶液的染着率几乎相等。

Figure 10. Photogram of the dyeing effect of crude red pigment solution (right) on the soybean curd cube
图10. 红色素粗提液(右)对豆腐块的染色效果照片

Table 2. Coloration efficiency of the red pigment solution to protein and starch food materials
表2. 红色素溶液对蛋白质、淀粉类食材的着色率
4. 结论
在分离产纤维素酶真菌的过程中,从发霉柚子皮壳分离出一株丝状真菌RedF。通过形态学特性分析和基因组多位点序列分型法鉴定菌株RedF为暗玫瑰篮状菌,命名为Talaromyces atroroseus RedF。在PDA平板中添加10 mg/L镉离子时,菌落生长形态发生变化,但镉离子对菌落形态建成影响在遗传接种上是可逆转的。水溶性红色素的最大吸收峰为503 nm。以察氏培养基为基础,添加0.3%羧甲基纤维素钠时,红色素产量最大;理化条件稳定性结果表明,红色素粗提液20℃~60℃条件下较稳定;低浓度(0.002 g/L)亚硫酸钠对红色素粗提液有增色效应;红色素在含H2O2微环境下稳定性下降;在NaCl盐度的增加时,红色素的稳定性下降。红色素粗提液对蛋白类、淀粉类物质的着色能力与稀释100倍的红曲色素相当。
微生物来源的水溶性天然色素在食品工业具有广泛应用前景。篮状菌属丝状真菌大多产生黄色和红色色素,其主要成分是嗜氮酮类聚酮化合物(azaphilone poliketides),其中红色素为红曲红色素。暗玫瑰篮状菌不产生任何已知的真菌毒素,因而有可能用于食用色素的工业化生产 [14] 。基于本研究对红色素的稳定性和着色性能研究结果,该菌株RedF可能作为水溶性红色素的生产菌,其产生的红色素在食品、化妆品等行业中具有一定的应用潜力。此外,菌株RedF在含有镉离子的PDA平板上生长形成特殊的菌落形态建成现象,可以进一步探究通过菌落形态变化对环境中重金属镉污染状况进行生物监测。
基金项目
湖南省自然科学基金项目(2020JJ6026);湖南省教育厅资助科研项目(19K030)。
NOTES
*通讯作者。