1. 引言
银杏在数亿年前就已经存在,是古老的中生代遗留下来的稀有树种 [1] 。我国的银杏资源十分丰富,拥有量占世界的80%以上 [2] 。银杏叶为药食同源物品,深加工较多,其富含20多种黄酮类化合物、萜类、多酚、维生素、氨基酸、微量元素和酚酸类等,可应用于食品、药品、化妆品等领域 [3] 。而银杏黄酮是银杏主要活性物质之一,其具有广谱的抑菌活性,展现了良好的天然防腐抑菌潜力,是目前该领域研究热点。银杏叶黄酮对细菌和真菌都具有抑菌效果,尤其是对细菌的抑菌效果更强 [4] 。Zhang等 [5] 研究发现银杏叶黄酮提取物对水产品中的致病菌希瓦氏菌和腐生葡萄球菌都有抑制作用。王婷等 [6] 发现银杏黄酮处理后对鲳鱼鱼肉品质下降和非酶化反应有很好的抑制作用,其中延缓K值、TVB-N值与pH的上升,显著延长其冰藏货架期,其贮藏货架期能延长至15 d,有效延缓了腐败变质。冯金霞等 [7] 研究表明,银杏叶黄酮能明显改善鲜切红富士苹果的外观质量,并能有效地控制其发生褐变反应,降低细菌的侵染等,更好地保持鲜切苹果果肉的品质。Kobus-Cisowska等 [8] 发现银杏黄酮添加进肉馅中,能有效地抑制脂肪在贮藏过程中的氧化和组织胆固醇过氧化物的产生,从而提高肉馅的质量。
目前市场上黄酮粗提物非常多,由于其杂质较多、纯度低,很难对其进行科学、有效的抗菌评价 [9] 。为此有必要进行分离纯化,为后续抗菌活性、抑菌机理进行探究提供物质基础。在银杏叶黄酮提取物中,黄酮含量较低,为了提高其生物学活性和可利用效率,必须经过分离纯化 [10] 。一般的溶剂萃取法除杂,萃取不充分,有机溶剂用量大,且容易造成溶剂残留,对后续的使用带来安全隐患。大孔树脂是一种可循环低污染的材料,大量用于天然提取物的纯化 [11] [12] [13] 。本研究目标是筛选适合纯化银杏叶黄酮的树脂,并通过动力学和热力学模型分析树脂吸附黄酮类化合物的机制,探究纯化的最佳条件。
2. 材料与仪器设备
2.1. 原材料
原材料:银杏叶黄酮提取物,购于江苏贝斯康药业有限公司;芦丁标准品(≥98%),购于南京广润生物制品有限公司;大孔树脂AB-8、NKA-9、D101、HPD-100、DM130,均购于郑州和成新材料科技有限公司;聚酰胺树脂(60~80目),购于上海易恩化学技术有限公司。
2.2. 主要试剂与仪器
JEM-2100F紫外分光光度计,奥益仪器有限公司;25 × 500 mm层析柱,北京欣维尔玻璃仪器有限公司;RE52CS-1旋转蒸发仪,上海亚荣生化仪器厂。
3. 实验方法 [14]
3.1. 黄酮含量的测定及标准曲线的绘制
采用NaNO2-Al(NO3)3-NaOH法测定总黄酮含量 [15] 。主要原理是基于黄酮类化合物在NaNO2-Al(NO3)3溶液体系中形成络合物,在强碱存在下变红,红色深浅与黄酮类化合物的含量成正比。具体测定的方法为:将0.5 mL的样品溶液和0.15 mL 5% (v/v) NaNO2转移至5 mL容量瓶中。6 min后加入0.15 mL 10% (v/v) Al(NO3)3。6 min后加入1 mL 4% (v/v)的NaOH,然后补充3.2 mL的去离子水至刻度线。20 min后在510 nm处测吸光度。标准品芦丁用作参考,绘制标准曲线。
3.2. 树脂的预处理
树脂预处理参照文献中的方法 [16] 。用浓度为95%的乙醇浸泡树脂12 h,去离子水彻底清洗,洗至没有乙醇气味,在5% NaOH溶液中浸泡5 h,去离子水洗涤2次,再用5% HCl溶液浸泡5 h,然后用去离子水彻底洗干净,直到洗后的去离子水pH为7左右。处理好的树脂在烘箱中干燥后备用。
3.3. NKA-9大孔树脂纯化银杏叶黄酮关键参数
3.3.1. 黄酮浓度对树脂吸附的影响
将银杏叶黄酮提取物以乙醇溶液配制成一系列浓度的黄酮吸附液。2 g (干重)预处理后的NKA-9树脂与不同浓度的黄酮提取物溶液(50 mL)转移到100 mL烧瓶中。烧瓶口密封后,在25℃下摇动(120 r/min)。待吸附过程达到平衡,测定黄酮浓度,计算吸附量和吸附率。
3.3.2. pH对大孔树脂吸附量的影响
称取预处理之后的NKA-9大孔树脂2 g,置于100 mL锥形瓶中。用乙醇溶液溶解银杏叶黄酮提取物,2 mol/L的盐酸和2 mol/L氢氧化钠溶液调节样品溶液的pH。不同pH样品溶液再与预处理后2 g (干重) NKA-9树脂混合,在100 mL锥形瓶中120 r/min振荡吸附18~24 h。测定吸附平衡后溶液中的总黄酮含量,得出最佳吸附pH。
3.3.3. 乙醇浓度对树脂解吸效果的影响
将吸附平衡后的NKA-9树脂过滤,再用去离子水冲洗去表面残留的黄酮溶液,平铺在滤纸上滤干水分,称取10份2 g的树脂转移至100 mL锥形瓶中,分别加入20 mL浓度为10%、20%、30%、40%、50%、60%、70%、80%、90%、100%的乙醇溶液,封口后将锥形瓶置于振荡器上,振荡解吸2 h后测解吸液中的黄酮浓度,计算解吸率。最高洗脱率对应最佳浓度。
3.3.4. 吸附流速的选择
取预处理后的NKA-9大孔树脂湿法上柱。用乙醇溶液将银杏叶黄酮提取物配制成黄酮含量为0.8 mg/mL的上样液。选择动态吸附流速0.3 BV/h、0.6 BV/h、1.2 BV/h (BV为树脂柱体积,柱体积 = 100 mL),将上样液按不同流速上样,每50 mL收集一次流出液。泄漏点附近每25 mL收集一次。测定各收集液中黄酮含量,绘制其浓度随体积的变化曲线,选择最佳流速。
3.3.5. 洗脱流速的选择
树脂吸附完全后,洗脱液的流速会影响到银杏黄酮的洗脱效果。流速过大,洗脱液与树脂交换不完全,溶质不能完全扩散到洗脱液中,树脂洗脱不完全,洗脱液流速过小,洗脱时间太长。根据静态解吸实验探究得到的实验结果,将动态解吸实验条件设置为解吸液70%乙醇,探究洗脱流速为0.5 BV/h、1.0 BV/h、1.5 BV/h对解吸效果的影响。
4. 实验结果 [14]
4.1. 黄酮含量的测定及标准曲线的绘制
芦丁标准品所作得到的标准曲线如图1所示。在浓度0.008~0.056 mg/mL范围内,具有良好的线形关系,可用来测定总黄酮的含量。
4.2. 树脂的筛选
大孔树脂通常为白色或淡粉色球形颗粒,其吸附主要取决于聚合物吸附剂与溶质之间的静电作用、氢键和尺寸筛选 [17] 。在树脂的吸附解吸过程中,吸附剂和吸附质之间的范德华力和氢键起着重要作用 [18] 。黄酮类化合物的分子结构中含有苯基、酚羟基、甲基、甲氧基以及糖苷等基团,也会造成极性的差异。一般来说,极性大孔树脂叫适合富集类黄酮 [19] 。
极性树脂NKA-9和弱极性树脂AB-8的吸附效果最好,说明树脂的极性并不是决定吸附性能的关键因素。NKA-9和AB-8都具有较大的孔径,说明较大的平均孔径有利于树脂吸附黄酮。NKA-9和AB-8都由聚苯乙烯结构构成,NKA-9平均孔径更大,吸附率和吸附量都更高。被吸附物质结构中的酚羟基,可以和聚酰胺树脂结构中的酰胺基形成氢键,作用力比范德华力更强 [20] ,因此聚酰胺树脂的解吸率最低。
静态吸附和解吸动力学曲线如图2所示。六种树脂的吸附和解吸趋势基本一致。在吸附过程的前一个小时,吸附速率比较快,然后开始放缓,最后基本稳定。当达到吸附平衡时,NKA-9大孔树脂对银杏叶黄酮的吸附率最高,吸附平衡时间在4 h左右,其次就是AB-8大孔树脂。非极性树脂D101和HPD100对黄酮类化合物的吸附率没有明显差异,吸附平衡较快,但吸附量较低。弱极性树脂DM130和聚酰胺树脂对黄酮类化合物的吸附率没有显著差异,但DM130大孔树脂的吸附平衡时间比聚酰胺短。可见,聚酰胺是一种吸附平衡时间较长,吸附量低的慢吸附型树脂。
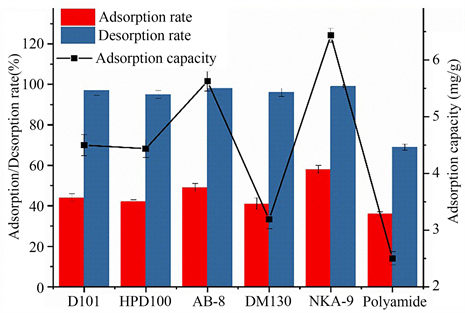
Figure 2. Adsorption/desorption properties of six resins
图2. 六种树脂的吸附解吸性能
六种树脂的解吸速率均较快如图3所示,解吸平衡时间均在2 h以内,解吸过程的第1小时解吸速率非常快,然后逐渐趋于平衡,基本解吸完成。NKA-9大孔树脂的解吸率最高,几乎达到100%,并且解吸平衡时间短,在1 h左右达到解吸平衡。AB-8大孔树脂的解吸率为(98.56 ± 0.62)%,与NKA-9树脂无显著差异。其次便是D101和DM130,相较之DM130的解吸速率更快。HPD100大孔树脂的解吸率为(92.87 ± 0.81)%,聚酰胺树脂的解吸率最低仅为(71.83 ± 1.28)%,并且解吸速率慢。通过比较6种树脂对银杏叶黄酮吸附解吸效果,确定NKA-9大孔树脂用于银杏叶黄酮的纯化。
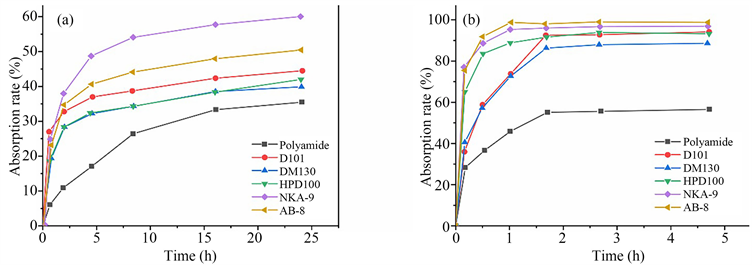
Figure 3. Kinetic curve of resins adsorption and desorption
图3. 树脂吸附和解吸动力学曲线
4.3. NKA-9大孔树脂纯化黄酮粗提物的工艺研究
4.3.1. 上样浓度对树脂吸附的影响
图4显示了上样浓度对树脂吸附率和吸附量的影响。由图中的两条折线趋势可以看出,当溶液中黄酮浓度增加,树脂对黄酮类化合物的吸附量不断增大,吸附率呈现先增大后降低的趋势。吸附率曲线的拐点大约在黄酮浓度为0.8 mg/mL,此时吸附率达到最大(65.47%)。当浓度大于0.8 mg/mL时,树脂吸附容量的增加速度减慢,吸附率迅速下降。这可能是因为在开始黄酮溶液浓度较低的时候,NKA-9大孔树脂上的结合位点较多 [21] ,因此随着黄酮浓度的升高,黄酮吸附量提高迅速,吸附率先增大,但随着树脂上的结合位点不断减少,吸附率会随之降低,吸附量趋于平稳。因此,最佳上样黄酮浓度为0.8 mg/mL。
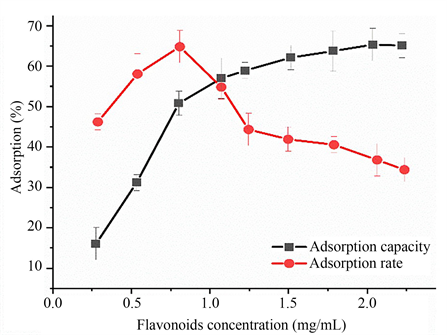
Figure 4. Effect of flavone concentration on resin adsorption rate and adsorption capacity
图4. 上样黄酮浓度对树脂吸附速率和吸附量的影响
4.3.2. pH对树脂吸附量的影响
样品初始pH是影响树脂吸附的重要因素,因为它会影响吸附分子的电离程度,从而影响吸附质和吸附剂之间的亲和力。上样液pH对树脂吸附黄酮类化合物含量的影响如图5所示。当溶液的pH值增大,树脂对银杏叶黄酮的吸附量呈现减小的趋势。当pH值为5时,吸附量达到最大值。银杏叶黄酮分子中含有酚羟基、羧基,呈现弱酸性,大多数研究表明树脂吸附往往发生在酸性或中性环境中。因此选择初始pH值为5作为初始溶液的pH所获得的黄酮吸附量最佳。

Figure 5. Effect of pH on adsorption capacity of NKA-9 macroporous resin
图5. pH对NKA-9大孔树脂吸附量的影响
4.3.3. 乙醇浓度对树脂解吸率的影响
乙醇被认为是大孔树脂的优选解吸剂,并且被广泛使用,因为它可以很容易的从溶液中旋蒸去除然后再次回收使用,不残留在样品中,而且价格便宜对样品相对无毒性。从图6可以看出,乙醇浓度对银杏叶总黄酮的解吸效率有显著影响。当乙醇浓度较低时(10%~40%),对黄酮的解吸率很低;当乙醇浓度从40%增加到70%,解吸速率逐渐增大,乙醇浓度对解吸率有显著的影响(p < 0.05)。当乙醇浓度超过70%时,浓度对解吸率无显著影响(p > 0.05)。因此,选择70%乙醇作为最终的解吸溶液。
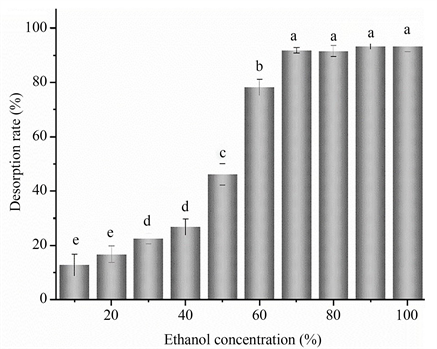
Figure 6. Effect of eluent concentration on desorption rate
图6. 洗脱液浓度对解吸率的影响
4.3.4. 上样流速对树脂吸附黄酮类化合物的影响
NKA-9大孔树脂吸附银杏叶黄酮提取物溶液的动态吸附曲线如图7所示。
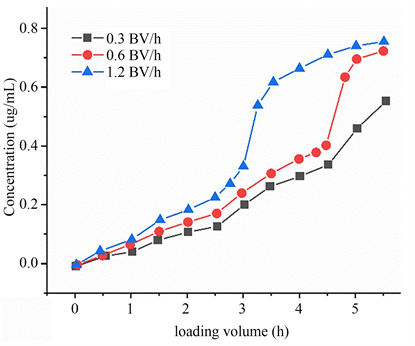
Figure 7. Dynamic adsorption curve of ginkgo flavonoids by NKA-9 macroporous resin
图7. NKA-9大孔树脂对银杏叶黄酮的动态吸附曲线
随着上样量的增加,越来越多的黄酮未能被树脂吸附而直接流出层析柱,说明树脂的吸附能力在逐渐减弱。当上样量小于3 BV时,流出液中银杏叶总黄酮浓度缓慢上升,大部分仍能被树脂吸附。上样达到5 BV时,大量的银杏叶黄酮类化合物泄漏,流出液中黄酮的浓度接近0.8 mg/mL,黄酮已经几乎不能被树脂吸附,表明树脂接近吸附饱和。样品液中黄酮类化合物的泄漏率随样品流速的增加而增加。当上样流速为1.2 BV/h时,流速太大,被吸附的物质来不及扩散就流过柱床,大量黄酮泄漏。当吸附流速为0.3 BV/h时,流速过缓,会造成吸附时间过长。因此,最佳上样流速为0.6 BV/h,最大上样体积为5.5 BV。
4.3.5. 洗脱流速对树脂解吸黄酮类化合物的影响
如图8所示,通过动态解吸曲线可以观察到洗脱体积和流速对解吸率的影响。为提高产品纯度和回收率,减少洗脱液消耗,研究了不同流速(0.5、1和1.5 BV/h)下的动态脱附曲线。在洗脱流速较低的条件下观察到更好的洗脱效果,流速越快,洗脱曲线对称性越差。虽然在1.5 BV/h的流速下黄酮类化合物能最早的在洗脱液中被检测出来,但是洗脱过程中黄酮类化合物的出峰区段不集中,需要消耗更多的洗脱剂,约5.5 BV的70%的乙醇才能完全将黄酮从树脂上洗脱下来。洗脱流速为0.5 BV/h时,需要的洗脱液体积约3.5 BV,但洗脱时间较长。因此,考虑到操作效率和洗脱液消耗,1.0 BV/h的洗脱流速最好,黄酮洗脱下来的时段集中,并且最大洗脱用量约4 BV。

Figure 8. Dynamic desorption curve of ginkgo flavonoids by NKA-9 macroporous resin
图8. NKA-9大孔树脂对银杏叶黄酮的动态解吸曲线
4.4. NKA-9大孔树脂纯化效果
根据上述单因素试验确定的最佳纯化条件下,将得到的洗脱液合并浓缩,冷冻干燥得到橙黄色的大孔树脂纯化物,用紫外分光光度法测得总黄酮含量为57.41% (见表1),说明纯化效果明显。

Table 1. Purity calculation of flavonoid extract from Ginkgo biloba leaves (n = 3)
表1. 银杏叶黄酮提取物纯化结果(n = 3)
5. 结论
本章比较了六种树脂对银杏叶总黄酮的吸附解吸性能,筛选出最适合纯化银杏叶黄酮的树脂,通过动力学和热力学模型分析了树脂吸附过程,并且确定了总黄酮的最佳纯化条件。具体的试验结果如下:
1) NKA-9大孔树脂对银杏叶黄酮的吸附解吸效果最好,平衡时的最大解吸率约为65.47%,最大吸附量约7.19 mg/g,吸附平衡时间约4 h;解吸平衡时间约1 h,最大解吸率达99.07%。
2) NKA-9大孔树脂纯化银杏叶黄酮提取物的工艺条件:样品的上样黄酮浓度为0.8 mg/mL,pH为5,上样流速0.6 BV/h,温度25℃;洗脱剂为70%的乙醇溶液,用量4 BV,流速1.0 BV/h,在此条件下纯化总黄酮从20.68%提高到57.41%。
基金项目
江苏省科技项目(苏北科技专项) (编号XZ-SZ202133)。
NOTES
*通讯作者。