1. 引言
橄榄又名福果、青果等,是橄榄科橄榄属植物的果实,栽植面积广,产率高,是一种很容易购买到的食材,具有很大的发展潜力 [1] 。橄榄果肉拥有丰富的营养价值,含钙量高而且容易被人体所吸收,可以通过开发和利用成为药品或者保健品;橄榄还有很高的药用价值,药用橄榄对降血压、血糖、血脂、糖尿病、咽喉肿痛、口腔溃疡、咳嗽、哮喘等病症有明显疗效 [2] 。
抗氧化剂目前广泛应用于食品加工,自然界中许多植物中的天然抗氧化成分因其安全、健康、无毒而得到人们越来越多的关注。而橄榄多酚作为一种自然抗氧化剂,是一种广泛存在与植物体内的多元酚,主要分布于物的皮、根、木、叶、果中,它也是一类具有独特生理活性和药理活性的天然产物。大量研究表明,橄榄多酚在抗诱变、抗肿瘤、抗病毒、抗微生物、抗衰老、抗氧化等很多方面具有良好的作用,具有很高的发展前景 [3] 。
DPPH自由基在517 nm波长附近存在最大吸收峰 [4] 。DPPH自由基和抗氧化剂反应后,抗氧化剂可以配对DPPH的孤对电子对使DPPH褪色,接受电子量与褪色程度呈定量关系,所以可用比色定量分析来测定橄榄多酚溶液的抗氧化能力,DPPH清除率越大,抗氧化能力越强 [5] 。因为该方法简单、快捷、灵敏,操作方便,所以本论文使用DPPH消除法来测定橄榄多酚的抗氧化性,并使用Vc和BHA这两种常用食品添加剂作为对比,反映橄榄多酚还原能力的强弱。
由于提取抗氧化剂的原材料不同,抗氧化剂可以采取多种提取方法。常用的有超声辅助提取法、微波辅助提取法、酸碱提取法、酶解法、醇浸法等 [6] 。罗永会等 [7] 用传统乙醇浸取橄榄多酚,有较好的提取率5.75%,但是耗时达到4 h。曾培源等 [8] 用超声提取橄榄多酚,工艺流程需要3次,每次40 min,得率2.3%。何志勇等 [9] 用微波提取,时间仅需5 s,得率1.2%。传统提取法消耗时间但提取率较高,现代提取法省时但提取率较低。
多酚类化合物在碱性溶液中,钨钼酸与体系中存在的酚羟基发生反应,钨离子从正六价转换为正五价,导致反应体系从青绿色转换为蓝色,溶液中蓝色的深浅程度与含酚基团的数目成正比,所以可以利用紫外/可见分光光度计测量溶液的吸光度,从而求得多酚的提取率 [10] 。
二次正交旋转组合设计是国外近年应用较多的一种实验设计方法。结合了响应面优化法,并且通过统计软件对实验结果进行非线性数学模型拟合。
该论文首先对超声时间、超声水浴温度、乙醇浓度、固液比四个因素分别进行单因素实验,研究这四个因素对橄榄多酚提取率的影响,得到各个因素的最佳条件所在的大致范围。再利用二次正交旋转组合设计,以单因素实验中各个因素的最佳条件作为中心水平,进行四因素五水平的正交实验设计,最终得到最佳的工艺参数。
2. 材料与方法
2.1. 仪器和试剂
橄榄粉(云南文山一缘药业),DPPH(西亚试剂),福林酚(广东光华科技股份有限公司)(阿拉丁),真空冷冻干燥机(上海比朗仪器制造有限公司),UV-1100紫外/可见分光光度计(上海美谱达仪器有限公司),TENSOR27傅立叶变换红外光谱(德国布鲁克公司)等。
2.2. 实验方法
2.2.1. 实验步骤
1) 用电子天平称取3 g橄榄干粉于250 mL锥形瓶中,加入指定乙醇浓度与固液比的乙醇溶液,混合均匀后将其放置于常温下的单槽式超声波清洗机(功率300 W)中,进行超声协同提取。提取一段时间后,通过纱布过滤后,将溶液离心后除去沉淀即初提取液。
2) 取1 mL初提取液稀释并定容到50 mL容量瓶,剩余提取液样品放置于冰箱保存待用。取1 mL样品于50 mL容量瓶中,滴加1.5 mL福林酚和10 mL去离子水,于避光处放置5 min后,加入6 mL的10%碳酸钠溶液,静置60 min反应过,在765 nm波长下测定吸光度,以焦性没食子酸为标量计算提取液中的多酚含量。
3) 将储存待用的提取液装入500 mL四口烧瓶中,通过水浴加热蒸出残留在提取液中的乙醇,得到脱醇溶液,装盘后放入冷冻箱结冰,次日放入冷冻干燥机进行脱水处理,得到橄榄多酚干粉。
4) 将干粉溶解于溶液中,稀释处理后,进行DPPH自由基消除能力、羟基自由基消除能力等抗氧化功能的测定。
2.2.2. 没食子酸标准曲线
1) 用电子天平准确称取焦性没食子酸0.0507 g,用蒸馏水溶解,定容至100 mL容量瓶备用,作为没食子酸标准液。
2) 用天平量取10 g无水碳酸钠固体,加入60 mL蒸馏水溶解,将碳酸钠溶液转移到容量瓶,用少量蒸馏水分别清洗烧杯三次,残液转移至容量瓶,定容,得到10% Na2CO3溶液。
3) 吸取3.0 mL、6.0 mL、9.0 mL、12.0 mL、15.0 mL没食子酸标准液分别定容于50 mL容量瓶内。然后从没食子酸系列梯度溶液中吸取1.0 mL溶液加入25 mL容量瓶中,加入10 mL蒸馏水摇匀,用移液管移取1.50 mL福林酚试剂,摇匀后放置在黑暗处,5 min后加入6 mL 10% Na2CO3溶液摇匀,然后在室温下避光放置反应60 min,以蒸馏水作参比,在波长765 nm处测定其吸光值。以吸光值为纵坐标,标准溶液浓度为横坐标,绘制标准曲线 [11] 。
2.2.3. 单因素实验
1) 超声时间对橄榄多酚提取率的影响
取3 g橄榄粉于250 mL锥形瓶中,加入65%乙醇100 mL (65 mL乙醇 + 35 mL蒸馏水),在50℃的超声水浴中加热30 min、40 min、50 min。用福林酚作显色剂测其吸光度。
2) 提取温度对橄榄多酚提取率的影响
取3 g橄榄粉于250 mL锥形瓶中,加入65%乙醇100 Ml (65 mL乙醇 + 35 mL蒸馏水),分别在40℃50℃、60℃、70℃下反应40 min。用福林酚作显色剂测其吸光度。
3) 乙醇浓度对橄榄多酚提取率的影响
取3 g橄榄粉于250 mL锥形瓶中,分别加入35%、45%、55%、65%乙醇100 mL。分别在50℃下反应40 min。用福林酚作显色剂测其吸光度。
4) 料液比对橄榄多酚提取率的影响
取3 g橄榄粉于250 mL锥形瓶中,分别加入65%的45 mL、60 mL、75 mL、90 mL的乙醇,分别在50℃下反应40 min。用福林酚作显色剂测其吸光度。
2.2.4. 二次正交旋转组合实验
由以上四个单因素实验可知,该四个因素均对提取率有较大影响,分别为:超声时间、温度、乙醇浓度、料液比,其中超声虽然随着时间增加产率仅有少量提升,出于实际生产效率仍选择40 min为中间水平。二次正交旋转组合实验设计分别使用−2,−1,0,1,2表示每个因素的5个水平,如表1。以橄榄多酚的提取率为目标,运用数据处理软件SAS得出,整个实验有36组,设计如表2,以优化橄榄多酚提取的最佳工艺条件 [12] 。
2.2.5. 用红外吸收光谱鉴定提取物成分
将冷冻干燥获得的橄榄多酚提取物干粉加入溴化钾研磨均匀成粉,取适量样品进行压片,得到薄膜片放入样品架在4000~400波数进行红外吸收光谱测量。
2.2.6. 橄榄多酚对DPPH消除率的测定
1) 1 m mol∙L−1 DPPH溶液的制备
用分析天平准确量取19.716 mg的DPPH固体定容于50 mL棕色瓶中,定容可得到1 m mol∙L−1的DPPH溶液。使用时需稀释10倍使用。
2) 橄榄提取物系列浓度梯度溶液制备
取0.25 g橄榄多酚提取物用无水乙醇定容于100 mL容量瓶,得到2.5 mg∙mL−1原液①。从原液①中量取2 mL橄榄溶液定容于50 mL容量瓶,得到0.1 mg∙mL−1溶液②。从溶液②中取10 mL溶液定容于50 mL容量瓶,得到0.02 mg∙mL−1溶液③。从溶液②中取5 mL定容于50 mL容量瓶中,得到0.01 mg∙mL−1溶液④。从溶液②中取2.5 mL定容于50 mL容量瓶中,得到0.005 mg∙mL−1溶液⑤。从溶液②中取0.5 mL定容于50 mL容量瓶中,得到0.001 mg∙mL−1溶液⑥。以上制备得到0.1 mg∙mL−1、0.02 mg∙mL−1、0.01 mg∙mL−1、0.005 mg∙mL−1、0.001 mg∙mL−1系列浓度梯度溶液。

Table 1. Combination experiment design of quadratic regression orthogonal
表1. 二次正交旋转组合实验设计表
3) 橄榄多酚对DPPH清除率的测定
分别用移液管移取0.1 mg∙mL−1、0.02 mg∙mL−1、0.01 mg∙mL−1、0.005 mg∙mL−1、0.001 mg∙mL−1的橄榄多酚溶液2.0 mL至试管中,分别加入2.0 mL乙醇和2.0 mL 0.1 m mol∙L−1的DPPH溶液,另外取一直空试管加入2 mL蒸馏水和2 mL 0.1 mmol∙L−1的DPPH溶液,作为空白样使用。将这一系列试管摇晃均匀后放置于黑暗处静置30 min,在波长517 nm处测定吸光度。用Vc作为参照,计算DPPH清除率。
(1)
其中,Ax为加入样品和DPPH溶液反应后的吸光度;Ay为加入样品和等体积乙醇溶液的吸光度;A0为空白对照样的吸光度。
4) Vc、BHA对DPPH清除率的测定
分别制备Vc、BHA系列浓度梯度溶液,得到0.1 mg∙mL−1、0.02 mg∙mL−1、0.01 mg∙mL−1、0.005 mg∙mL−1、0.001 mg∙mL−1的Vc溶液和BHA溶液。分别移取各样品溶液2.0 mL至试管中,分别加入2.0 mL乙醇和2.0 mL 0.1 m mol∙L−1的DPPH溶液,另外取一直空试管加入2 mL蒸馏水和2 mL 0.1 m mol∙L−1的DPPH溶液,作为空白样使用。将这一系列试管摇晃均匀后放置于黑暗处静置30 min,在波长517 nm处测定吸光度 [13] 。
2.2.7. 二次回归正交旋转组合设计实验
二次回归正交旋转组合设计实验用spss软件进行方差分析和显著性检测进行分析后,再用sas软件拟合二次回归正交优化方程,最后matlab软件对提取因素间的交互作用进行分析。
3. 结果与分析
3.1. 福林酚测定没食子酸浓度标准曲线
据步骤2.2.2.得回归方程y = 10.028x − 0.0355,R2 = 0.99862,表明在0.02~0.12 mg∙mL−1的浓度范围内,没食子酸浓度x与吸光度y之间有很好的相关性,如图1所示:
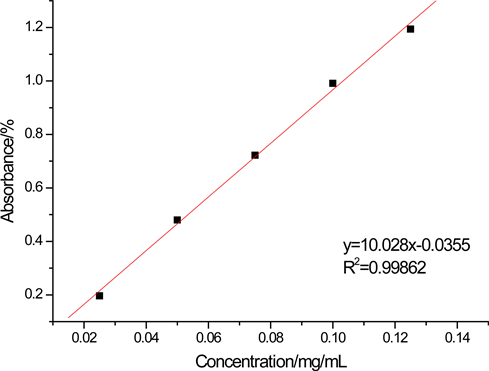
Figure 1. The standard curve of gallic acid
图1. 没食子酸标准曲线
3.2. 单因素实验结果
3.2.1. 超声时间对橄榄多酚提取率的影响
由图2可知,在40 min内,随着超声提取时间的增长,多酚得率逐渐增大,当超声时间延长到40 min以后,多酚得率稍微下降,随着时间增长,得率只有不显著的增长,在实际生产中,40 min的生产效率更高,故选择超声提取时间为40 min。
3.2.2. 温度对橄榄多酚提取率的影响
由图3可知,在40℃到70℃的范围内,水浴温度对多酚得率有一定的影响,且在70℃左右到达最

Figure 2. Effect of ultrasonic time on yield of oleuropein
图2. 超声提取时间对橄榄多酚得率的影响
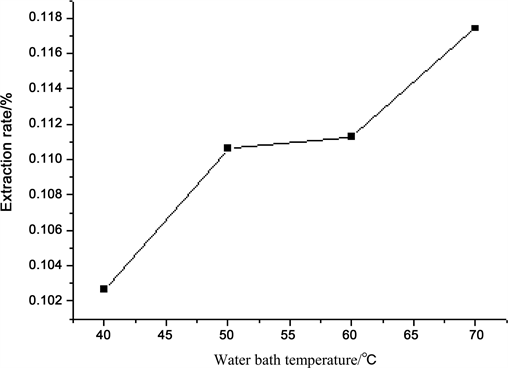
Figure 3. Effect of water bath temperature on yield of oleuropein
图3. 水浴温度对橄榄多酚提取率的影响
高点,故使用70℃水浴温度为最佳实验条件。
3.2.3. 乙醇浓度对橄榄多酚提取率的影响
由图4可知,在35%到65%的范围内,多酚得率随着浓度增加,呈先增加而降低的趋势。乙醇浓度对在55%范围内,随着百分数的增加,多酚得率增加,在55%的时候达到最高点,之后缓慢下降,故选择乙醇浓度55%为实验最佳条件。
3.2.4. 料液比对橄榄多酚提取率的影响
由图5可知,在1:20到1:30的范围内,随着乙醇用量的增加,多酚得率增加,到1:30时,多酚得

Figure 4. Effect of ethanol concentration on yield of oleuropein
图4. 乙醇浓度对橄榄多酚得率的影响

Figure 5. Effect of solid-liquid ratio on yield of oleuropein
图5. 料液比对橄榄多酚得率的影响
率达到最高点,之后有明显下降,故选择1:30为最佳条件 [14] 。
3.3. 二次回归正交旋转实验优化提取条件
由表2的实验结果,运用spss软件进行方差分析和显著性检测。由表3方差分析可知,模型整体sig值为0.012远小于0.05但接近于0.01,可见模型的显著性一般,其决定系数R2 = 0.790,说明模型拟合效果一般,实验存在一定的误差率。
由表3可见sig值小于0.05的项,x1远小于0.01,为主要影响显著的因素,x2和x3小于0.05,为显著性一般的因素,故影响因素主效应的顺序为x1 (超声时间) > x3 (乙醇浓度) > x2 (温度) > x4 (固液比)。从交互项来看,温度和乙醇浓度的交互作用、温度和固液比的交互作用均接近0.2,为交互项中最为显著的两项,可以想到因为温度的提高使乙醇溶液蒸发导致提取液的体积变小,影响到乙醇浓度和固液比两个因素对提取率的作用,所以乙醇浓度和固液比两个因素与其他因素的交互性的显著性较低。特别是体积减小影响最大的固液比显著性最低,导致了整体误差的增大。
显著性低的交互项去掉,使用sas软件拟合方程:
(2)
使用matlab软件对乙醇浓度、温度和固液比制作交互图。


Table 2. Design of quadratic regression orthogonal rotation combination experiment
表2. 二次回归正交旋转组合实验设计表

Table 3. Analysis of variance and significance test
表3. 方差分析与显著性检测
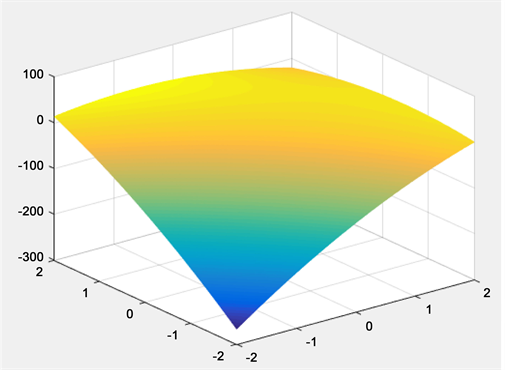
Figure 6. The Interaction between extraction temperature and ethanol concentration
图6. 提取温度和乙醇浓度交互图

Figure 7. The Interaction between extraction temperature and solid-liquid ratio
图7. 提取温度和固液比交互图
由图6~图8可知,当响应面的坡度趋向平滑时,说明响应值受各个变量的影响较小;当响应面趋向倾斜时,则说明响应面受变量交互作用较为明显。通过比较图6~图8比较可知,温度、乙醇浓度和固液比这三个因素之间交互关系一般 [15] [16] [17] [18] 。
通过回归拟合方程分析出橄榄多酚最佳工艺参数为:超声时间37.3 min、水浴温度46.36℃、乙醇浓度为43.24%,固液比为1:32.5。考虑操作方便,修正最佳工艺为:超声时间37 min、水浴温度46℃、乙醇浓度为43%,固液比为1:32,在此条件下平行验证三次,实验结果为13.87%、13.92%、13.97%,平均值接近13.92%。
3.4. 红外吸收光谱
从图9的光谱图中可以看到,在3409.19 cm−1波长处,有一个较强的吸收峰,可能是由于-OH的伸缩振动造成;而在2975~2850 cm−1处弱的吸收峰为C-H的伸缩振动。在1034.14 cm−1处为C-H3的弯曲振

Figure 8. The Interaction between ethanol concentration and solid-liquid ratio
图8. 乙醇浓度和固液比交互图
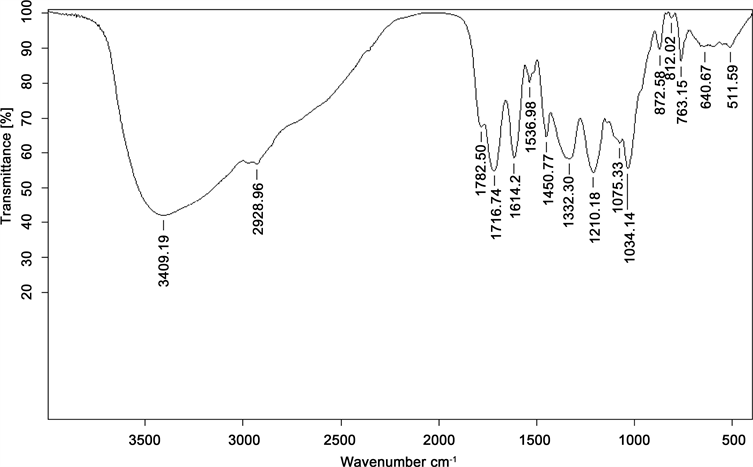
Figure 9. The Fourier infrared spectrogram of oleuropein
图9. 橄榄多酚的傅里叶红外光谱图

Figure 10. Comparison of the DPPH radical scavenging rate with oleuropeins, Vc and BHA
图10. 橄榄多酚、Vc、BHA对DPPH自由基的消除率对比图
动。在1450.77 cm−1处为C-H的弯曲振动。在1332.3 cm−1处为O-H的弯曲振动。可以得知,提取物成分存在酚类物质 [19] 。
3.5. 橄榄多酚抗氧化测定结果与分析
由图10中可知,在实验范围内,橄榄多酚的对DPPH清除能力处于Vc和BHA之间,不同浓度的橄榄多酚溶液对DPPH的清除率随浓度升高而增加。在低浓度范围内,清除率和质量浓度有明显的正相关性,随着浓度升高,消除率趋于平缓,逐渐趋近于96%。虽然橄榄多酚对DPPH自由基的消除率相对于Vc略低,但是它在高浓度时仍有效果,当质量浓度为0.1 mg∙m−1 L时,VC的消除率为98%,橄榄多酚的消除率大约为96.7%,BHA的消除率为94.7%,橄榄多酚的消除率介于这两种食品添加剂之间,可见橄榄多酚对DPPH消除效果显著 [20] 。
4. 结论
本文采用了超声辅助提取橄榄多酚的工艺,通过单因素和二次回归旋转正交试验的方法,确定了提取橄榄多酚工艺的最佳条件,即超声时间37 min、水浴温度46℃、乙醇浓度为43%,固液比为1:32。从影响提取率的因素来看,超声时间越长,提取率虽然有所增加但是逐渐趋近于平缓,在实际制作工艺过程中会使得成本增加,故应取提取率效率最高的超声时间。同时也并不是水浴温度越高,固液比越高,乙醇浓度越高,橄榄多酚的提取率就越高。故达到最佳条件附近时,橄榄多酚的提取达到饱和。
橄榄多酚对DPPH溶液的消除效果很高,介于Vc和BHA这两种公用食品添加剂中间,可见橄榄多酚作为抗氧化剂有较为显著的效果。因为温度上升,导致液体体积下降,乙醇浓度变化,所以温度和溶液体积、乙醇浓度的交互作用比较难以控制,导致了模型显著性的减低,如果使用更好的密封装置,可以使模型显著性更高,模型的公信力越强。
基金项目
2017年佛山科学技术学院省级大学生创新创业项目编号(201711847115)。
NOTES
*通讯作者。