1. 引言
水稻纹枯病是水稻三大病害之一,一般会造成水稻减产10%~30%,严重时可达50% [1] 。张国良等 [2] 在研究硅对增强水稻成株期纹枯病抗性的影响时发现,硅能够降低水稻植株的纹枯病发生率。1991年,Razak通过研究发现硒可以抑制和减少作物的某些真菌性病害,在植物的生长过程中有着重大意义 [3] 。硅和硒通过一系列的生理生化反应和信号传导过程,激活寄主防卫基因,诱导了植株系统抗病性 [4] [5] [6] 。长期以来,学者对上述观点仍存在争议。但越来越多的研究发现,硅和硒可能参与植物的代谢过程,激活防卫基因,导致与植物抗病性相关代谢物质的积累及抗病相关酶活性的提高,从而增强植株的抗病性 [7] [8] [9] [10] 。本研究以高感纹枯病水稻品种春优78为材料,研究了纹枯菌胁迫后,外源用硅和硒诱导水稻对纹枯病的抗性以及对水稻生长和水稻体内防御相关酶的影响。
2. 材料和方法
2.1. 供试水稻品种
春优78。
2.2. 供试菌种
水稻纹枯病菌(Rhizoctonia solani)安徽农业大学植物保护学院植病流行与绿色防控实验室。
2.3. 供试试剂
亚硒酸钠(Na2SeO3)、二氧化硅(SiO2)。
2.4. 诱导剂的制备
用精密电子天平准确称取Na2SeO3 0.100 g和SiO2 0.100 g,然后分别用蒸馏水定容到1000 mL,配制成浓度为100 μg/mL的母液。实验时将母液配成不同浓度的Na2SeO3溶液和和不同浓度的SiO2溶液备用。
2.5. 水稻种植
将事先准备好的春优78水稻种子泡在5%的次氯酸钠溶液内10 min,然后用自来水反复冲洗3次,用纯水洗2次,最后用纯水浸泡24 h。将滤纸铺在充分湿润的培养皿里,然后把种子放于培养皿中并在30℃潮湿及黑暗的条件下培育48 h。待种子发芽后铺撒在带有泥土的培养盘中种植。
2.6. 亚硒酸钠和二氧化硅对水稻抗纹枯病的诱导作用
在硒和硅对水稻纹枯病菌及纹枯病的影响预试验基础上,明确了亚硒酸钠适合的诱导浓度范围小于5 μg/mL,二氧化硅适合的诱导浓度范围小于15 μg/mL。因此设计亚硒酸钠诱导水稻抗纹枯病的浓度梯度为5.0 μg/mL、2.5 μg/mL、1.0 μg/mL和0.5 μg/mL;二氧化硅诱导水稻抗纹枯病的浓度梯度为15.0 μg/mL、10.0 μg/mL、5.0 μg/mL、2.5 μg/mL和1.0 μg/mL;纯水作为对照。
将不同浓度的亚硒酸钠和二氧化硅溶液喷洒处理长至三叶一心的水稻植株叶片上,以叶片湿润且有液滴滴落为准。试验设15株水稻为1个处理,设置3次重复。并于处理后48 h采用菌丝块接种水稻纹枯病菌,用灭菌的7 mm的打孔器将培养2 d的水稻纹枯病菌打孔并用镊子夹出接种于水稻叶鞘处,接种后将水稻植株放置于温度为28℃~30℃,湿度85%左右,光照12 h与黑暗12 h光照强度1600 Lx的培养室中,每天观察水稻发病情况,并于10 d后调查水稻纹枯病的发病情况。水稻纹枯病等级按四级划分:0级,全株无病;1级,第3叶片以下各叶鞘、叶片发病;2级,第2个叶片以下各叶鞘、叶片发病;3级,顶叶叶鞘或顶片发病;4级,全株发病,提早死亡。计算病情指数和控病效果,用DPS软件进行统计分析。
病情指数 = ∑(各级病株数 × 相对应级别)/(调查总株数 × 最高级值) × 100。
控病效果(%) = (对照病情指数 − 处理病情指数)/对照病情指数 × 100。
2.7. 亚硒酸钠和二氧化硅对水稻植株生物量的影响
水稻三叶一心期时,分别设置喷施300 mL的5 μg/mL亚硒酸钠溶液、15 μg/mL二氧化硅溶液和亚硒酸钠+二氧化硅(1:1)溶液的不同处理,以纯水为对照。同时没置喷施300 mL的5 μg/mL亚硒酸钠溶液、15 μg/mL二氧化硅溶液和亚硒酸钠+二氧化硅(1:1)溶液后于48 h后接种水稻纹枯病菌,温室内温度保持在28℃~30℃、湿度85%。每个处理设3次重复。25 d后收集样品,去除样品表面杂质,测量水稻株高和植株鲜重量。试验数据采用SPSS 19.0进行方差分析。
2.8. 亚硒酸钠、二氧化硅诱导后对水稻相关防御酶活性的影响
对三叶一心期的水稻苗进行诱导剂最佳诱导浓度激发处理。实验共设6个处理,每处理25株水稻幼苗,设3次重复。处理 1:亚硒酸钠诱导 + 接菌;处理2:亚硒酸钠诱导 + 未接菌;处理3:二氧化硅诱导 + 接菌;处理4:二氧化硅诱导 + 未接菌;处理5:对照(CK1)纯水 + 接菌;处理6:对照(CK2)纯水 + 未接菌。6个处理溶液对水稻植株进行均匀的喷施,喷施后48 h接菌,分别于处理后0 d、1 d、2 d、3 d、5 d、7 d和9 d经过处理的水稻植株相同部位取叶片,分别用分光光度法、紫外吸收法和紫外分光法来测定多酚氧化酶(PPO)、过氧化氢酶(CAT)和苯丙氨酸解氨酶(PAL)的活性 [11] [12] [13] 。
3. 结果与分析
3.1. 亚硒酸钠和二氧化硅对水稻抗纹枯病的诱导作用
3.1.1. 不同浓度亚硒酸钠诱导水稻抗纹枯病的效果
由表1可以看出,以纯水为对照的发病率达92.42%,病情指数为91.11。与对照相比,各浓度处理的水稻发病率及病情指数均低于对照组。随着亚硒酸钠浓度的增加,控病效果也增加,不同浓度间的控病效果存在显著差异(表1,图1),亚硒酸钠浓度为2.5~5.0 μg/mL 的处理控病效果达40%。

Table 1. The effect of sodium selenite on rice resistance to Sheath blight
表1. 亚硒酸钠诱导水稻抗纹枯病的控病效果
注:表中同一列中小写字母不同,表示存在极显著差异(p < 0.05),下同。

Figure 1. The incidence of rice sheath blight induced by sodium selenite at different concentrations, Note: (a), (b), (c), (d), (e) and (f) were incidence of rice sheath blight induced by sodium selenite concentration of 5.0, 2.5, 1.0, 0.5, 0.1 and 0 μg/mL, respectively
图1. 不同浓度亚硒酸钠诱导后水稻纹枯病发病情况。(a)、(b)、(c)、(d)、(e)和(f)分别为5.0、2.5、1.0、0.5、0.1 μg/mL亚硒酸钠和清水对照处理的发病情况
3.1.2. 不同浓度二氧化硅诱导水稻抗纹枯病的效果
以纯水为对照的发病率达达92.31%,病情指数为86.66,各处理与对照相比,随着二氧化硅浓度的增加,控病效果也增加(表2),不同浓度间的控病效果存在显著差异(表2,图2),二氧化硅浓度为10.0~15.0 μg/mL的处理控病效果大于46%。
3.2. 硒和硅诱导诱导后对水稻防御酶活性的影响
3.2.1. 对多酚氧化酶(PPO)活性的影响
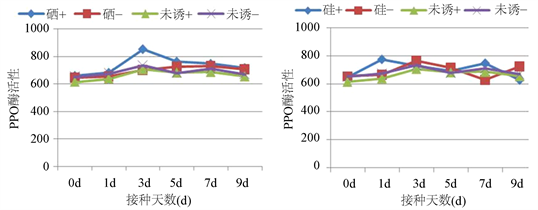
由图3(a)可知,经硒处理的PPO活性高于未经硒处理,经硒 + 接菌处理PPO活性在初期呈上升趋势,于第3 d达到峰值,比硒 + 不接菌高1.22倍,比未诱导 + 接菌处理高1.20倍。由图3(b)可知,经硅处理的PPO活性高于未经硅处理,经硅 + 接菌处理PPO活性在初期呈上升趋势,于第1 d达到峰值,比硅 + 不接菌高1.16倍,比未诱导 + 接菌处理高1.21倍。

Table 2. The effect of silica on rice resistance to Sheath blight
表2. 二氧化硅诱导水稻抗纹枯病的控病效果

Figure 2. The incidence of rice sheath blight induced by silica at different concentrations, Note: (a), (b), (c), (d), (e) and (f) was incidence of rice sheath blight induced by silica concentration of 5.0, 2.5, 1.0, 0.5, 0.1 and 0 μg/mL, respectively
图2. 不同浓度二氧化硅诱导后水稻纹枯病发病情况。注:(a)、(b)、(c)、(d)、(e)和(f)分别为15.0、10.0、5.0、2.5、1.0 μg/mL二氧化硅和清水对照处理的发病情况
 (a) (b)
(a) (b)
Figure 3. Effect of different inducers on PPO activity in rice leaves. Note: “+” indicates inoculation; “−” indicates no inoculation, (a) indicate treatment of sodium selenite; (b) indicate treatment of silica
图3. 不同诱导剂对水稻叶片PPO酶活性的影响。注:“+”表示接菌;“−”表示不接菌;(a) 为亚硒酸钠诱导;(b) 为二氧化硅诱导
3.2.2. 对过氧化氢酶(CAT)活性的影响
由图4(a)可知,经硒 + 接菌处理CAT活性在初期呈快速上升趋势,于第3 d达到峰值,比硒 + 不接菌高1.20倍,比未诱导 + 接菌高1.12倍,后缓慢下降,在整个测定点内CAT活性均高于未诱导 + 接菌、未诱导 + 不接菌处理;经硒 + 不接菌处理CAT活性呈快速上升趋势,在第1 d已经达到峰值,后快速下降,且在第7 d达到最低值,后又上升。由图4(b)可知,经硅 + 接菌处理CAT活性在初期呈上升趋势,于第3 d达到峰值,比未诱导 + 接菌高1.58倍,后呈缓慢下降趋势;经硅 + 不接菌处理CAT活性初期呈快速上升趋势,于第3 d达到峰值,比硅 + 接菌高1.38倍,比未诱导 + 接菌高1.79倍,后又急剧下降,第5 d达到最低值,在第7 d达到另一个峰值,但低于第3 d酶活性。
 (a) (b)
(a) (b)
Figure 4. Effect of different inducers on CAT activity in rice leaves. Note: “+” indicates inoculation; “−” indicates no inoculation, (a) indicate treatment of sodium selenite; (b) indicate treatment of silica
图4. 不同诱导剂对水稻叶片CAT酶活性的影响。注:“+”表示接菌;“−”表示不接菌;(a)为亚硒酸钠诱导;(b)为二氧化硅诱导
3.2.3. 对苯丙氨酸解氨酶(PAL)活性的影响
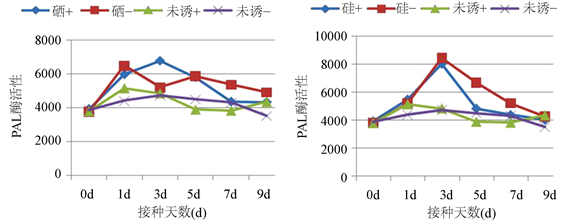
由图5(a)可知,经硒 + 接菌处理PAL活性在初期呈上升趋势,于第3 d达到峰值,比硒 + 不接菌高1.30倍,比未诱导 + 接菌处理高1.40倍,且整个测定点内PAL活性均高于未诱导 + 接菌、未诱导 + 不接菌处理;经硒 + 不接菌处理PAL活性初期急剧上升,于第1 d已达到峰值,且活性高于硒 + 接菌处理,且在第7 d达到另一个峰值,但低于第1 d的峰值。由图5(b)可知,经硅 + 接菌处理和硅 + 不接菌处理PAL活性变化趋势相同,在初期呈上升趋势,于第3 d达到峰值,明显高于未诱导 + 接菌、未诱导 + 不接菌处理PAL活性,后呈下降趋势,且硅 + 不接菌处理整个测定点内PAL活性均高于硅 + 接菌处理。
3.3. 硒及硅诱导后对水稻植株生物量的影响
3.3.1. 硒及硅诱导对水稻植株株高的影响
对照的接菌组和不接菌组的水稻平均株高分别为33.29 cm和32.70 cm。经二氧化硅诱导处理后,水稻植株接菌组平均株高达39.13 cm,不接菌组平均株高达39.59 cm,经亚硒酸钠诱导处理后,水稻植株接菌组平均株高达39.10 cm,不接菌组平均株高达39.48 cm,与对照相比,两者差异极显著;经过诱导剂诱导处理后的水稻无论是否接种水稻纹枯病菌,水稻植株株高都显著高于对照组(只喷施纯水),接菌与不接菌间,硒与硅之间,株高均无显著差异,说明经硒及硅诱导后对水稻生长具有促进作用(表3)。
 (a) (b)
(a) (b)
Figure 5. Effect of different inducers on PAL activity in rice leaves. Note: “+” indicates inoculation; “−” indicates no inoculation, (a) indicate treatment of sodium selenite; (b) indicate treatment of silica
图5. 不同诱导剂对水稻叶片PAL酶活性的影响。注:“+”表示接菌;“−”表示不接菌;(a)为亚硒酸钠诱导;(b)为二氧化硅诱导

Table 3. The effect of inducer induction on plant height of rice
表3. 诱导剂诱导对水稻植株株高的影响
注:“+”表示接菌;“−”表示不接菌。
3.3.2. 硒及硅诱导对水稻植株鲜重的影响
经二氧化硅诱导处理后,水稻植株接菌组平均鲜重达19.77 g,不接菌组平均鲜重达19.61 g,两者差异不显著;经亚硒酸钠诱导处理后,水稻植株接菌组平均鲜重达20.09 g,不接菌组平均鲜重达19.39 g,两者差异不显著;经过硒及硅诱导处理后的水稻无论是否接种水稻纹枯病菌,水稻植株鲜重都显著高于对照组(只喷施纯水),接菌与不接菌间,硒与硅之间,鲜重均无显著差异,说明经硒及硅诱导后对水稻生长具有促进作用(表4)。

Table 4. The effect of inducer induction on plant weight of rice
表4. 诱导剂诱导对水稻植株重量的影响
注:“+”表示接菌;“−”表示不接菌。
4. 小结与讨论
结果表明,用亚硒酸钠5.0 μg/mL和二氧化硅15.0 μg/mL诱导水稻,能有效提高水稻抗纹枯病的能力,控病效果分别为41.27%和47.43%。同时,经硒、硅诱导后不论接或不接种水稻纹枯病菌,水稻株高和植株鲜重与对照相比均有显著的提高。这与前人关于硒和硅可以降低作物病害发生率,增强植物抗病能力的研究结果一致 [11] [12] [13] [14] 。
多酚氧化酶(PPO)、过氧化氢酶(CAT)和苯丙氨酸解氨酶(PAL)等都与植物体内的防卫反应相关,这些酶在一定程度上反映了植物的抗病性的强弱。本文研究了纹枯菌胁迫后,外源施硅和硒对纹枯病感病品种春优78体内防御相关酶的影响。结果表明,接种水稻纹枯病菌后,用硅和硒接种处理与不用硅和硒接种处理相比,植株体内PPO、CAT和PAL有增加的趋势;不接种纹枯病菌时,用硅和硒与不施硅和硒处理之间上述酶活性差异不大。用硅和硒诱导能调节植株体内与抗性有关的生理生化反应,从而抵抗病原菌的侵染。但硅和硒对诱导植物抗性的机制及其影响途径是由多方面因素决定的,并不局限于此,也可能不是对所有的诱导抗性机制都有效 [11] 。因此,对硅和硒在诱导植物抗性机制方面的研究仍需进一步深入,以便更全面合理地揭示硅和硒的抗病机制。
目前,水稻纹枯病仍主要采用化学农药防治,由于化学农药的大量及不合理使用,使得水稻纹枯病菌对农药产生了抗药性,不仅降低药效,且造成农药残留和严重的生态环境污染问题,不符合农药减量增效和绿色防控要求。本研究通过硒、硅诱导水稻,能增强水稻抗纹枯病能力,提高防病效果,为水稻纹枯病的绿色防控提供了基础。
基金项目
安徽省重点研发项目水稻主要病虫害绿色防控及农药减施增效关键技术研究(1804a07020139)和国家重点研发项目长江中下游水稻化肥农药减施增效技术集成研究与示范项目(2016YFD0200806)资助。
NOTES
*共一作者。
#通讯作者。