1. 引言
近年来,肥胖的发生率在全球范围内持续不断增长,满足超重或肥胖的人数超过20亿,约占世界人口的30% [1] [2]。肥胖是一种复杂的慢性代谢紊乱,其特征是脂肪过多,脂肪细胞增生和肥大导致脂肪组织膨胀,从而导致体重增加 [3]。肥胖的并发症有心血管疾病、糖尿病和癌症等 [4],肥胖和其并发症不仅对人体健康带来严重危害,亦对社会经济及医疗卫生体系造成沉重负担。
中药代茶饮是将一种或多种具有保健或治疗作用的中草药与茶叶配用,或者不与茶叶配用但是以“茶饮”方式服用的饮品。中药代茶饮具有副作用小,药性平和,适合长期坚持服用的特点,能够缓和其效,尤其适于慢性病的治疗及对机体机能的调整。所以,将中药代茶饮应用于改善肥胖是一种具有积极意义的新思路。
通过对各代茶饮方中55味药物进行药物使用频次和性味分析,本项目开发了包含决明子、桑叶、玉米须、茶树花、山楂五种中草药的中药代茶饮——清脂茶。因为清脂茶对肥胖人群的改善作用仍然缺乏科学研究和理论依据,所以本文旨在探究清脂茶的减肥降脂功效和其发挥功效的物质基础。
2. 材料与方法
2.1. 动物及主要试剂
清洁级ICR雄性小鼠购自扬州大学比较医学中心;决明子、桑叶、玉米须、茶树花和山楂购自修明堂药店;甘油三酯(TG)试剂盒购自南京建成生物工程研究所;总胆固醇(TC)试剂盒购自南京建成生物工程研究所。
2.2. 仪器与设备
GWP分析天平(AG Laboratory & Weighing Technologies)、离心机(湘仪仪器有限公司)、移液枪(Thermo)、酶标仪(Gen 5 mBALB/coplate Data collection & Analysis Sofeware)、Image Pro Express分析系统、GraphPad Prism数据分析系统、色谱柱(Waters Atlantis@T3,(4.6 × 250 mm, 5 μm)、Agilent 1260高效液相色谱仪(美国安捷伦科技公司)、Agilent 1260-6530 QTOF液相色谱–质谱分析仪(美国安捷伦科技公司并配有MassHunter数据分析系统)。
2.3. 小鼠分组、造模与给药
ICR小鼠适应性喂养7 d后,先根据体重随机分成空白组(10只)和造模组(20只),待肥胖模型建立成功后,再将造模组分成模型组(10只)和清脂组(10只)。造模期间每日饲喂空白组小鼠正常基础饲料5 g/只,饲喂造模组小鼠高脂饲料5 g/只(高脂饲料的配方为43.5%基础饲料 + 30.4%鸡蛋 + 8.7%猪油 + 8.7%牛奶 + 8.7%黄豆粉),小鼠可以自由饮水。25 d建模周期结束后,将各组小鼠空腹12 h后称重,若造模组体重与空白组相比具有显著性差异(p < 0.01),则高脂模型建立成功。模型建立成功后开始给药。称取适当粉碎后的决明子、桑叶、玉米须、茶树花和山楂各0.76 g共3.80 g置于100 mL开水,冲泡20 min,过滤去渣,取澄清茶液(380 mg/kg)给清脂组小鼠灌胃,同时将空白组和模型组小鼠灌胃等体积蒸馏水溶液,给药周期为30 d。实验过程中,每日同一时间称重,记录小鼠体重变化。末次灌胃后,禁食12 h,再将小鼠麻醉并处死,收集血清、肝脏和肾和睾丸周围脂肪组织样本,于−80℃保存备用。
2.4. 肥胖指数的测定
小鼠空腹12 h后称重(g),处死后测量其体长(cm),计算出小鼠的肥胖指数,公式如下 [5]:
2.5. 脂肪指数测定
用电子天平称小鼠肾和睾丸周围脂肪总重量(g),计算出小鼠脂肪指数,公式如下 [6]:
2.6. 血清生化指标测定
将收集的血液3000 r/min离心10 min,得到血清备用。最后检测血清中甘油三酯(TG),总胆固醇(TC)水平,生化指标按试剂盒说明书进行测定。
2.7. 肝脏生化指标测定
取300 mg肝组织剪碎,加入RIPA裂解液在冰浴中匀浆,裂解1 h后在2500 r/min,4℃条件下离心10 min,取上清液,测定相关生化指标。按照试剂盒操作步骤测定肝匀浆甘油三酯(TG)、总胆固醇(TC)。
2.8. 脂肪细胞观察
各组随机取5只小鼠肾周围脂肪组织块,用10%中性福尔马林固定,脱水,石蜡包埋。切片经HE染色,应用Image Pro Express分析系统,光学显微镜(400×)下观察小鼠脂肪切片病理状态,对比各组脂肪细胞形态及大小。
2.9. 有效成分分析
将清脂茶基础配方原料桑叶、玉米须、茶树花、山楂、决明子各药0.76 g共3.80 g置于100 mL开水中浸提30 min,得到茶液,使用旋转蒸发仪浓缩至10 mL,通过0.22 μm微孔滤膜,取续滤液,即得供试品备用。色谱柱为Waters Atlantis@T3,以乙腈-0.1%乙酸为流动相进行梯度洗脱(具体梯度如表1所示);检测波长:273 nm;流速:1 mL/min;柱温:30℃。取供试品10 μL注入液相色谱仪,按上述条件进行高效液相–质谱联用技术(HPLC-Q-TOF-MS)分析 [7]。

Table 1. Changes of gradient elution mobile phase with time
表1. 梯度洗脱流动相随时间变化表
2.10. 统计分析
所有实验数据采用x ± SD表示,采用GraphPad软件进行One-way ANOVA分析。P值小于0.05即被认为差异具有统计学意义。
3. 实验结果与分析
3.1. 小鼠肥胖模型的建立
小鼠肥胖模型建立结果如图1所示,在25 d的造模期间,各组小鼠体重都呈现上升趋势,值得注意的是,造模组小鼠(模型组和清脂组)体重均显著增加,与空白组小鼠的体重相比具有显著性差异(p < 0.001)。这表明高脂饲料诱导的肥胖小鼠模型建立成功。

Figure 1. Weight changes of mice during establishing fat model (***p < 0.001)
图1. 高脂建模期间体重变化(***p < 0.001)
3.2. 清脂茶对小鼠体重的影响
造模组小鼠的肥胖模型建模成功后,分成模型组和清脂组,由图2中第0 d可知,模型组与清脂组之间的体重并无显著性差异(p > 0.05),说明模型组和清脂组的组间平衡性较好,分组合理。我们发现在接下来30 d,空白组小鼠和模型组小鼠的体重均呈现上升趋势,而清脂茶的干预抑制了清脂组小鼠体重的增长幅度。在第30 d时清脂组小鼠体重水平明显低于模型组(p < 0.01),且与空白组的体重接近。这说明清脂茶能够有效抑制肥胖小鼠的体重增加。
3.3. 清脂茶对小鼠肥胖指数的影响
肥胖指数又称Lee’s指数,主要反映动物机体的肥胖程度。由图3可知,模型组小鼠肥胖指数水平高于空白组(p < 0.05)。与模型组相比,清脂组小鼠的肥胖指数水平出现了显著地下降(p < 0.001),这提示给予清脂茶能够显著性地降低肥胖程度。
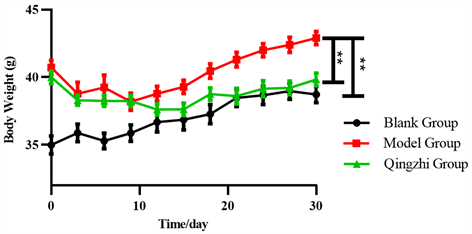
Figure 2. Effects of Qingzhi tea on weight loss of fat rats (n = 10, **p < 0.01)
图2. 清脂茶灌胃期间体重变化(n = 10, **p < 0.01)

Figure 3. Influence of Qingzhi tea on obesity index of mice (n = 8, *p < 0.05, ***p < 0.001)
图3. 清脂茶对小鼠肥胖指数的影响(n = 8, *p < 0.05, ***p < 0.001)
3.4. 清脂茶对小鼠体脂含量的影响
长期高脂饮食所导致的营养性肥胖的典型特征是腹腔中脂肪堆积过多,总脂肪质量和脂肪系数都能反映小鼠脂肪性肥胖的程度。如图4、图5所示,模型组总脂肪质量和脂肪指数与空白组比较均有所上升(分别p < 0.01和p < 0.05),然而清脂组与模型组相比,其总脂肪质量被显著性降低(p < 0.001),脂肪指数呈现明显下降(p < 0.01)。这表明清脂茶的干预有助于减少脂肪堆积、改善小鼠的脂肪性肥胖程度。

Figure 4. Influence of Qingzhi tea on fat weight of mice (n = 8, **p < 0.01, ***p < 0.001)
图4. 清脂茶对小鼠总脂肪质量影响(n = 8, **p < 0.01, ***p < 0.001)

Figure 5. Influence of Qingzhi tea on fat index of mice (n = 8, *p < 0.05, **p < 0.01)
图5. 清脂茶对小鼠脂肪指数影响
3.5. 清脂茶对小鼠血脂的影响
如图6所示,模型组小鼠血清中检测到的TG水平与空白组相比明显上升(p < 0.01),清脂组小鼠血清中的TG含量与模型组相比显著下降(p < 0.001),这说明清脂茶能够降低肥胖小鼠的TG水平。同样,如图7所示,清脂茶的干预还能降低清脂组小鼠血清中TC水平(p < 0.05)。这表明清脂茶干预后能明显降低小鼠血清TG和TC水平。

Figure 6. Effect of Qingzhi tea on blood triglycerides in mice (n = 6, **p < 0.01, ***p < 0.001)
图6. 清脂茶对小鼠的血清甘油三酯的影响(n = 6, **p < 0.01, ***p < 0.001)

Figure 7. Effect of Qingzhi tea on blood total cholesterol in mice (n = 6, *p < 0.05)
图7. 清脂茶对小鼠的血清总胆固醇的影响(n = 6, *p < 0.05)
3.6. 清脂茶对小鼠肝脏生化指标的影响
肝脏是合成和贮存TG、TC的主要器官。如图8所示,与空白组相比,模型组小鼠肝脏中检测到的TG水平明显上升(p < 0.001),而清脂组小鼠肝脏中的TG水平与模型组相比显著下降(p < 0.001)。此外,如图9所示,清脂茶还能降低清脂组小鼠肝脏中TC的水平。以上结果表明清脂茶能够抑制小鼠肝脏合成TG和TC。
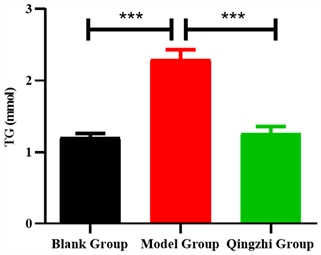
Figure 8. Effect of Qingzhi tea on liver triglycerides in mice (n = 6, ***p < 0.001)
图8. 清脂茶对小鼠的肝脏甘油三酯的影响(n = 6, ***p < 0.001)

Figure 9. Effect of Qingzhi tea on liver total cholesterol in mice (n = 6, **p < 0.01)
图9. 清脂茶对小鼠的肝脏总胆固醇的影响(n = 6, **p < 0.01)
3.7. 清脂茶对脂肪组织的影响
肥胖发生时伴随着脂肪组织的重构 [5]。HE染色后观察各组脂肪组织,光学显微镜下观察各组脂肪组织的结果如图10所示。空白组脂肪组织边界清晰,排列整齐。模型组脂肪组织与空白组相比,出现了边界模糊、肥大增生,同时还伴有炎症浸润现象。然而清脂组小鼠的脂肪组织炎症程度有所减轻,结构更加完整。这说明清脂茶能够有效改善肥胖小鼠的脂肪组织病理状态。
3.8. 高效液相色谱分析结果
通过HPLC-Q-TOF-MS技术得到如图11所示的液相图谱,再对一级质谱精确分子量以及二级裂解碎片数据的分析,初步鉴定出茶液中的8种成分,如表2所示。
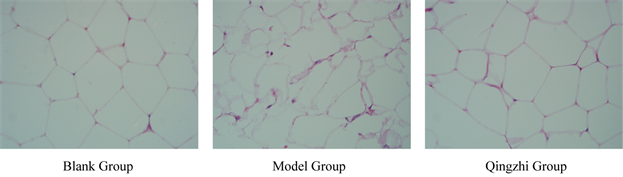
Figure 10. Fat tissue observed after HE staining (×400, n = 5)
图10. 各组脂肪细胞组织切片(HE染色,×400,n = 5)

Figure 11. HPLC-Q-TOF-MS chromatogram of Qingzhi tea
图11. 清脂茶HPLC-Q-TOF-MS色谱图

Table 2. Lipid reducing compounds in tea
表2. 清脂茶中具减脂作用的化合物
4. 讨论
根据《中华人民共和国药典》、《新食品原料安全性审查管理办法》(卫计委令2013年第1号)和药食同源物质推荐饮食量以确定最适于人体摄入的清脂茶量为42 mg/kg [6] [7],每日灌胃剂量按人60 mL/kg计算,则小鼠灌胃剂量为380 mg/kg [8]。因此,我们选取该剂量进行动物学实验,结果显示,以380 mg/kg剂量服用清脂茶30 d能够明显改善高脂饮食小鼠的肥胖状态,减轻小鼠体重。
根据HPLC-Q-TOF-MS技术分析结果,清脂茶中含有橙黄决明素葡萄糖苷、新橙皮苷和绿原酸等物质,冯艳平等 [9] 曾经报道,橙黄决明素葡萄糖苷是决明子的活性成分,具有较好的降脂功能,尤其是对TG含量的降低比较明显。二氢黄酮类化合物新橙皮苷也具有良好的调节血脂作用 [10]。并且,杨玉彬及梁秀慈 [11] [12] 等人在研究中表明绿原酸对高脂乳诱导小鼠具有降低血糖和血脂的作用,可抑制前脂肪细胞分化,抑制脂肪堆积。这些报道与本实验结果均具有一致性。而清脂茶的减肥机制有可能与抑制脂肪酸合成酶的活性、抑制消化酶活性或抑制脂肪酶活性有关。
本项目明确证明了清脂茶具有减肥和降脂的功能,由于其采用药食同源材料,在一定程度上保证了安全性,可以作为一种功能性食品进一步开发。但是决明子、桑叶、玉米须、茶树花和山楂是如何相互作用起效仍有待研究,此外,后续还将进一步研究其发挥减肥降脂的具体作用机制。
基金项目
国家级大学生创新创业训练计划项目(项目号:202010316010G)。
NOTES
*共同第一作者。
#通讯作者。