1. 引言
太子参为石竹科多年生草本植物孩儿参(Pseudostellaria heterophylla)的干燥块根,在我国辽宁、内蒙古、河北、陕西、山东、江苏等地有野生分布,日本、朝鲜亦见相关报道 [1],目前,国内主要有福建、贵州、安徽、江苏等太子参人工栽培产区。柘荣太子参以色泽晶黄、块根肥大、有效成分高而为医药界所重用,“柘荣太子参”是中国闻名的道地药材,其作为临床常用补益药,性甘平,味微苦,具益气健脾、生津润肺之功效,用于脾虚体倦、食欲不振、病后虚弱、气阴不足、自汗口渴、肺燥干咳等症 [2]。研究显示,太子参主要包括太子参多糖 [3]、蔗糖、麦芽糖、α-槐糖 [4] 等糖类、太子参皂苷A [5]、刺槐苷 [6] 等苷类、环肽类 [7] [8]、黄酮类、氨基酸、甾醇、油脂、挥发油等 [6] [9] [10] 化学成分。
中药多糖具有增强机体免疫功能及抗肿瘤等药理作用。太子参多糖是太子参中所含的一种水溶性组成成分,具有重要的药理作用。本课题组研究表示太子参多糖对糖尿病足溃疡,小肠溃疡均有良好的疗效,国内外的研究表明其具有抗心肌缺血、调节人体免疫、抗糖尿病作用。本研究对不同生长时期太子参多糖类成分进行提取,应用硫酸–苯酚比色法测定其含量,并对其进行比较分析,考察多糖类成分的含量变化特征,为确定最佳采收期、种植条件打下基础,也为种参的选择提供参考 [11] [12] [13] [14]。
2. 材料、仪器与试剂
2.1. 材料
样品采集于柘荣县太子参种植地,分别在太子参成熟期和太子参的育种期选样采摘(图1),标记分装,干燥,选择3块不同的地界选样(图2),每批取样3份,干燥,粉碎过3号筛备用。
2.2. 仪器
UV-3200型紫外可见分光光度计(配备UV-VIS Analyst紫外分光应用系统,上海美普达仪器有限公司);AE240S电子分析天平(梅特勒–托利多有限公司);HH-6数显恒温水浴锅 (国华电器有限公司);DHG-9123A电热恒温鼓风干燥箱(上海精宏实验设备有限公司)。

Figure 1. Breeding period and maturity stage of Pseudostellariae heterophylla. (A) Breeding period; (B) Maturity stage
图1. 太子参育种期和成熟期。(A) 育种期;(B) 成熟期

Figure 2. Sampling position. (A) 27.212 degree north and 119.849 east; (B) 27.205 degree north and 119.854 east; (B) 27.188 degree north and 119.826 east
图2. 采样地点。(A) 北纬27.212,东经119.849;(B) 北纬27.205,东经119.854;(C) 北纬27.188,东经119.826
2.3. 试剂
D-无水葡萄糖对照品(批号:110833-201908,中国食品药品检定研究院);硫酸(分析纯,批号:190123,西陇化工股份有限公司);苯酚(分析纯,批号:0191018,西陇化工股份有限公司)、无水乙醇(分析纯,批号:2021023,西陇化工股份有限公司)。
3. 方法与结果
3.1. 供试品制备
取供试品粉末约2.000 g,置于索氏提取器中,精密称定,加入90%乙醇100 ml,95℃水浴加热3 h,弃去乙醇溶液,烘箱50℃烘干,药渣连同纸筒置于圆底烧瓶中,准确加入100 ml蒸馏水,称重;100℃水浴加热回流提取2 h,冷却至室温,加水补重,混匀,离心(转速为每分钟4000转) 15分钟。精密量取上清液2 ml,置15 ml离心管中,精密加入无水乙醇10 ml,摇匀,冷藏1小时,取出,离心(转数为每分钟4000转),弃去上清液,必要时过滤,沉淀加80%的乙醇洗涤2次,每次8 ml,离心,弃去上清液,沉淀加水溶解,转移至100 ml量瓶中,加水至刻度,摇匀,即得供试品溶液。
3.2. 对照品溶液的制备
准确称取葡萄糖标准品8.12 mg,溶解后在100 ml容量瓶内用蒸馏水准确定容至刻度即得浓度为81.2 μg/ml的储备液。
3.3. 标准曲线的制备
精密量取对照品溶液4.0 ml、5.0 ml、6.0 ml、7.0 ml、8.0 ml,分别置10 ml容量瓶中,各加水至刻度线定容,得系列标准溶液。精密量取各对照品溶液l ml,置10 ml具塞试管中精密加入5%苯酚溶液l ml (临用配制),摇匀;再精密加硫酸5 ml,摇匀。置沸水浴中加热20分钟,取出,置冰浴中冷却5分钟,以相应试剂为空白,照紫外-可见分光光度法(《中国药典》通则0401),在最大吸收波长处测定吸光度,以吸光度为纵坐标,浓度为横坐标,绘制标准曲线。
3.4. 方法学考察
对葡萄糖标准品的精密度以及供试液中多糖的重现性、稳定性、回收率进行考察。
1) 葡萄糖标准品的精密度考察:另精密量取葡萄糖对照品溶液1.0 ml,加水至2.0 ml,显色后分别测定吸光度,重复测定5次,计算RSD。
2) 供试液中多糖的重现性考察:另精密称取太子参2.0 g,按2.1方法平行制备供试液5份,稀释150倍,精密量取供试品溶液1.0 ml,依法测定吸光度。
3) 供试液中多糖的稳定性考察:另精密称取太子参2.0 g,按2.1方法制备供试液,密封放置于冰箱中储存,精密量取供试品溶液1.0 ml,于显色后0、12、24、48、72 h,测定吸光度。
4) 供试液中多糖的回收率考察:精密称取太子参样品1.0 g和葡萄糖0.0205 mg平行制备供试液5份,测定吸光度。
5) 样品测定:将不同生长期的样品分别制备供试品并进行测定。
4. 实验结果
4.1. 最大吸收
检测波长的确定以水为空白,葡萄糖标准品溶液在390~590 nm波长范围内测吸光度,在486 nm处有最大吸收度。最大吸收波长如图3所示:

Figure 3. Maximum absorption of glucose reference substance
图3. 葡萄糖对照品最大吸收图
4.2. 标准曲线
苯酚–硫酸法标准曲线在486 nm处测定各标准液的吸收度,得回归方程A = 0.0106C − 0.007,r = 0.9947,表明葡萄糖对照品溶液在20~80 μg/ml浓度范围内呈良好的线性关系。回归标准曲线由图4所示。
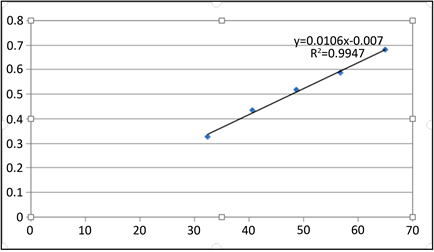
Figure 4. Standard curve of glucose reference substance
图4. 葡萄糖对照品的标准曲线
4.3. 葡萄糖标准品的精密度考察
依3.2方法制备溶液,重复测量5次吸光度,计算其含量RSD为0.15%。说明该标品的精密度良好。
4.4. 供试液中多糖的重现性考察
根据3.1过程制备供试液,详细记录数据及测量每次的吸光度,计算样品多糖含量的重现RSD为0.98%。说明供试液多糖含量的重现性良好。
4.5. 供试液中多糖的稳定性考察
根据3.1过程制备供试液,在不同的时段测定其吸光度,记录。计算其含量RSD为1.56%。结果表明供试液在显色后72 h内稳定。
4.6. 供试液中多糖的回收率考察
根据3.1过程制备供试液,测定其吸光度,取5次测定的平均值计算回收率为99.56% (n = 5),供试液中多糖回收率的RSD为1.32%,回收率实验结果见表1。

Table 1. Experiment of recovery rate of test solution
表1. 供试液回收率实验
4.7. 不同生长期太子参含量测定
分别将当归三批样品,按3.1法制备供试液,分别稀释不同倍数,用苯酚-硫酸法显色,紫外分光光度法进行含量测定结果见表2。

Table 2. Comparison of sugar content of Pseudostellaria heterophylla in different growth stages (n = 3)
表2. 不同生长期太子参糖类含量的比较(n = 3)
5. 分析与讨论
1) 本实验通过乙醇脱脂除杂后纯水回流提取多糖,用苯酚–硫酸法显色,分别测量得出育种期和成熟期太子参的多糖含量,实验的方法学考察结果说明此法实验数据可靠,可用于多糖含量测定。
2) 由实验结果可知,相较于成熟期太子参,种参的多糖含量更高。太子参种参是成熟期太子参经人工筛选后保留于田中继续生长,发芽后扦插种植,实验结果说明了在这段时间内的植物体内多糖类物质仍在持续合成并储存,产生了大量的营养物质向块根进行了转移,保证了种参的正常发育和代谢产物的蓄积,符合植物的正常发展规律。
基金项目
福建省属公益类科研院所基本科研专项(2018R1035-6)。
NOTES
*通讯作者。