1. 引言
成纤维细胞激活蛋白α (Fibroblast Activation Protein, FAPα)是由肿瘤基质成纤维细胞表达的一种膜结合蛋白 [1]。大量研究表明 [2] [3] [4],FAPα能降解细胞外基质的组成成分从而导致肿瘤细胞的行为发生改变,有特殊的生物学特性,在肿瘤–宿主界面基质的降解以及重建中发挥着重要作用,对肿瘤的浸润、转移及逆转具有重要意义。由于FAPα在恶性肿瘤基质中具有的高表达与肿瘤的发生和发展密切相关。因此,选择FAPα高表达的肿瘤基质作为肿瘤治疗靶标,比传统的细胞毒药物的治疗方式更有优势。
鬼臼毒素(Podophyllotoxin,图1(a))是从小檗科植物华鬼臼中分离得到的一种木脂素 [5]。研究表明,鬼臼毒素抗肿瘤作用机制主要为抑制微管蛋白 [6]、拓扑异构酶II [7]、自由基作用 [8]、抑制血管增生 [9] 等。但鬼臼毒素具有水溶性较差、毒副作用较强且易产生耐药性等缺陷,严重制约了它的临床应用。虽然对鬼臼毒素进行了大量的结构改造,相继也发现了诸如依托泊苷(图1(b))、替尼泊苷(图1(c))等抗肿瘤药物 [10]。但这些结构改造的药物依然存在明显的骨髓抑制作用,目前仅作为二线抗肿瘤药物使用。因此,寻找更高效低毒、选择性更好的抗肿瘤药具有重要的临床意义。
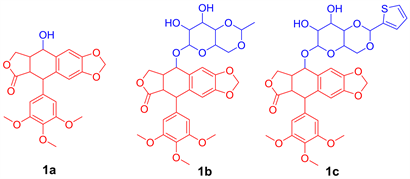
Figure 1. Chemical structure of podophyllotoxin and its derivatives with antitumor activities. 1a: Podophyllotoxin; 1b: Etoposide; 1c: Teniposide
图1. 鬼臼毒素及其抗肿瘤衍生物的化学结构。1a:鬼臼毒素;1b:依托泊苷;1c:替尼泊苷
随着信息技术的快速发展,计算机辅助药物设计已广泛用于指导多种新药的研发 [11]。为加速新型鬼臼毒素抗肿瘤活性分子的发掘,结合鬼臼毒素有效结构修饰位点为4-OH,本文以FAPα酶为抗肿瘤靶标,借助计算机辅助设计技术,虚拟设计鬼臼毒素(图2(a))与FAPα酶特异性底物(N-苄氧羰基甘氨酰-L-脯氨酸,图2(b))偶联的结构信息,期望获得可激活FAPα酶而产生抗肿瘤活性的鬼臼毒素前体药物分子,为后期进一步研究鬼臼毒素该类分子提供具有潜力的化合物。
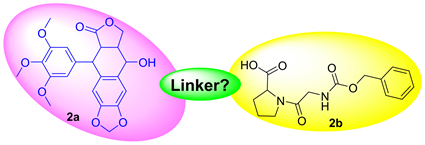
Figure 2. Virtual design of podophyllotoxin (2a) and N-benzyloxycarbonylglycine-L-proline (2b)
图2. 鬼臼毒素(2a)与N-苄氧羰基甘氨酰-L-脯氨酸(2b)的虚拟设计示意图
2. 对接实验
2.1. 小分子设计及处理
采用ChemBioDraw Ultra 14.0绘制小分子,用ChemBio3D Ultra 14.0进行能量最小化,将Minimum RMS Gradient设置为0.001,将小分子保存为mol2格式。将优化好的小分子导入AutodockTools-1.5.6进行加氢、计算电荷、分配电荷、设置可旋转键后保存为“pdbqt”格式。
2.2. 蛋白的准备及处理
从PDB (http://www.rcsb.org/)数据库下载FAPα酶(PDB ID: 1Z68)的晶体结构,使用PyMoL (2.3.0)去除FAPα酶的原始配体和水分子,将蛋白导入AutoDocktools (v1.5.6)进行加氢、计算电荷、分配电荷、指定原子类型并保存为“pdbqt”格式。
2.3. 参数文件的准备
以x = 38.033,y = 0.39,z = 69.392为中心坐标;格点盒子的大小设定为80 × 80 × 80 (每个格点的间距为0.375Å),其余参数为默认设置。
2.4. 结果分析方法
分子对接方法(Molecular docking method)是通过化学计量学方法模拟分子的几何结构和分子间作用力来进行分子间相互作用识别并预测受体-配体复合物结构的方法。本实验采用Autodock vina进行分子对接虚拟筛选,Autodock vina以结合能(affinity)来表示小分子与靶蛋白结合的好坏,结合能小于0代表小分子与靶蛋白可自由结合,数值越小则结合的可能性越高 [12] [13]。同时,利用PyMOL和Ligplot对结合能(affinity)前5的化合物进行相互作用模式分析。
3. 结果与分析
3.1. 分子设计及评分
采用上述模拟对接分析方法,共计获得134个Linker化学结构。其中,Affinity评分小于−9.5 kcal/mol的结构共有30个,偶连结构示意图与详细结构分别见图3、表1。
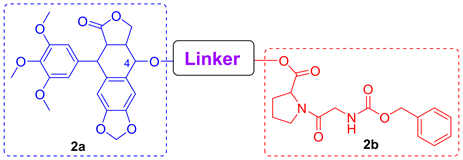
Figure 3. Diagram of coupling structure between podophyllotoxin (2a) and N-benzyloxycarbonylglycine-L-proline (2b)
图3. 鬼臼毒素(2a)与N-苄氧羰基甘氨酰-L-脯氨酸(2b)偶连结构示意图

Table 1. Virtual molecular structure with Affinity score less than −9.5 (Affinity unit: kcal/mol)
表1. Affinity评分小于−9.5的虚拟分子结构(Affinity单位:kcal/mol)
*:结构片段左端与鬼臼毒素4-OH相连,右端与N-苄氧羰基甘氨酰-L-脯氨酸的游离羧基相连。
3.2. 结果可视化及相互作用模式分析
根据分子设计的情况,选取Affinity分值前五的化合物(序号为78、29、47、48、49的化合物)等进行可视化及相互作用模式分析。结果发现,五个通过虚拟设计的分子与FAPα酶的多个氨基酸残基分别具有多个位点的疏水作用(表2)。同时,序号为78、47、48、49的虚拟分子还分别可以与FAPα酶的Tyr113、Leu153、Leu105等氨基酸残基形成氢键。说明这五个化合物与FAPα酶有很好的结合作用,具备采用化学合成进行生物活性再验证的潜力。
通过序号为78、29、47、48、49的虚拟分子分别与FAPα酶相互作用可视化分析时发现,虚拟分子结构中的鬼臼毒素结构片段,几乎主要与FAPα酶Trp155、Ser156、Pro157、Trp214等氨基酸残基位点具有疏水作用。FAPα酶特异性底物(N-苄氧羰基甘氨酰-L-脯氨酸)则主要与Lys209、Tyr126、Try210、Thr208、Tyr124等残基位点具有疏水作用。而通过虚拟设计的连接片段(即Linker)与Tyr113、Leu153、Leu105、Gly104、Cys154、Asn60等多个残基具有较高的亲和力,甚至可以与之形成多个氢键,结果见图4。

Table 2. Interaction of compounds with FAPα enzyme in the first five Affinity scores
表2. Affinity分值前五的化合物与FAPα酶的相互作用

Figure 4. Results of molecular docking with FAPα enzyme in the first five Affinity scores. A: FAPα enzyme structure; B: molecule 78; C: molecule 29; D: Molecule 47; E: molecule 48; F: 49 molecule
图4. Affinity分值前五的分子与FAPα酶对接结果。A:FAPα酶结构;B:78号分子;C:29号分子;D:47号分子;E:48号分子;F:49号分子
4. 结语
目前,对肿瘤发病机制的认识已经在分子水平上取得了突破性的进展,抗肿瘤药物研发的焦点正在从传统的细胞毒类药物转移到针对肿瘤细胞内信号转导通路的新型抗肿瘤药物 [14],即靶向抗肿瘤药物。由于FAPα酶特异性高表达于肿瘤基质,是一个值得深入研究的抗肿瘤靶点。虽然目前关于激活FAPα的抗肿瘤前体药物分子研究较多,但未见任何相关前体药物面市,绝大多数该类分子还存在临床前或临床研究阶段。因此,研发新型FAPα酶激动剂具有重要的临床意义。
连接臂(Linker)是化学成分结构修饰中常用的技术方式之一,且Gly、Ser、Pro、Ala、Thr等氨基酸被视为常用的Linker,尤其是Gly、Ser的应用最为广泛 [15]。Gly在所有氨基酸中的分子量最小,没有手性碳,柔性最好,且不会影响靶蛋白的构象和功能,空间位阻也最小 [15]。同时,Linker的长度是融合基因构建的一个重要因素,如果Linker长度过长,会降低获得目标分子的活性。而选用较短的Linker,则又可能因两个分子距离太近导致生物活性降低 [15]。鉴于大量采用Linker进行结构修饰的报道以及Linker过长或过短对生物活性的影响,本文在进行虚拟筛选时,将鬼臼毒素与FAPα酶特异性底物(N-苄氧羰基甘氨酰-L-脯氨酸)之间的Linker控制长度为3~4个化学键,最终成果获得134个虚拟分子,所有分子的Affinity值均在7.0以上。随后对Affinity值前五的化合物通过分子对接进行可视化分析,进一步确认了这些虚拟分子与FAPα酶的结合情况,为FAPα酶激活式鬼臼毒素抗肿瘤前体药物分子的开发提供有价值的化合物,使后期研究的方向性更加准确,进而加速该类分子的研究进度。
基金项目
贵州省科技计划项目(黔科合基础[2020]1Y397号);遵义市科技计划项目(遵市科合社字[2018]37号);全国大学生科研项目(2020QDS010号)。
NOTES
*通讯作者。