1. 引言
1,2,4-恶二唑的首次合成于1884年由Tiemann和Krüger完成 [1],最初名为呋喃[ab1]二唑(furo[ab1]diazoles)。1,2,4-恶二唑作为药物的早期应用促进了它们的研究。奥索拉明(Oxolamine,图1)是第一种上市的3,5-取代-1,2,4-恶二唑的药物,证明了1,2,4-恶二唑基团在药物化学领域的价值。随后将1,2,4-恶二唑环做为酯键和酰胺键的生物电子等排体应用于药物研究中 [2] [3],增加了这类化合物在药物化学研究中的作用。
1,2,4-恶二唑化合物是一种有这广泛研究的药学支架,已成为毒蕈碱受体激动剂 [4],苯二氮卓受体部分激动剂 [5],多巴胺转运蛋白 [6],促生长激素分泌物 [7] 和5-HT激动剂 [8]。同时1,2,4-恶二唑显示出很大的药学应用潜力,如也已被用作β3肾上腺素能受体激动剂中的尿素生物甾体 [9],S1P1激动剂 [10] 和mGlu5受体激动剂 [11]。同时1,2,4-恶二唑类化合物在材料学上也有这广泛的应用,如:液晶材料 [12],离子液体 [13],金属离子传感器 [14],发光材料 [15],含能材料 [16] 和气体储存材料 [17]。
由于3,5-取代-1,2,4-恶二唑类化合物具有广泛的药物活性及材料学价值,其合成方法也自然引起了人们的极大兴趣和关注。本文根据国内外的研究现状,对最新研究进行概述以及对未来发展进行展望。
2. O-乙酰氨基肟中间体脱水合成
2.1. 酰胺肟和羧酸的合成
大部分羧酸和酰胺肟偶联是使用EDC,HATU,DCC等偶联剂,此类方法需要12小时以上的反应时间,并且在某些情况下收率不是很高。为了改进这些情况,Porcheddu等人 [18] 和Ramu等人 [19],将羧酸化合物的无水四氢呋喃或无水二氧六环中溶解,后加入CDMT (2-氯-4,6-二甲氧基-1,3,5-三嗪)和N-甲基吗啉搅拌混合物。30分钟后完全转化为中间体加入酰胺肟以甲苯为溶剂微波5分钟或二氧六环回流,可得到1,2,4-恶二唑化合物。该方法的特点是反应时间短,通用性强,产率高,并且手性构型不会反转(图2)。
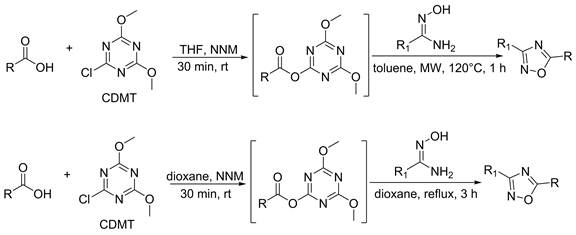
Figure 2. CDMT catalyzed coupling dehydration ring synthesis
图2. CDMT催化偶联脱水合环合成
水作为自然界最为常见的无毒溶剂有着廉价和环保的特点。在2010年Duchet等人 [20],使用DCC作为偶联剂,乙腈为溶剂得到O-乙酰氨基肟中间体。但将中间体O-乙酰氨基肟转化为1,2,4-恶二唑化合物的溶剂换为水,降低了此方法的环境污染(图3)。
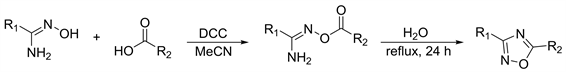
Figure 3. Dehydration and ring closure with H2O as solvent
图3. 以水为溶剂脱水合环
离子液体由于其低挥发性、不燃性和潜在的可回收特性而受到广泛关注。基于此2014年Nowrouzi等人 [21],开发简单,绿色的基于离子液体一锅法合成1,2,4-恶二唑化合物。将腈类化合物,羧酸化合物和羟胺添加到4-(二甲基-氨基)吡啶鎓乙酸盐中。在100℃下搅拌。6小时后,将离子液体溶解在水中并过滤以分离产物,重结晶就可得到纯净的1,2,4-恶二唑化合物,收率为83%~93% (图4)。
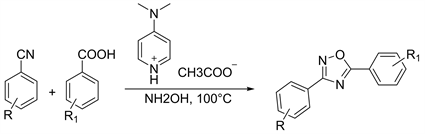
Figure 4. Dehydration and ring closure with ionic liquid as solvent
图4. 以离子液体为溶剂脱水合环
2.2. 酰胺肟和酰氯的合成
微波能加速有机反应的应用日益引起人们的兴趣,并且比传统技术具有节约节耗、加快反应速率、减少反应时间、环境污染小等优点。而且,微波反应可以避免使用溶剂,这使得合成的污染被减小。在2007年Kaboudin等人 [22],使用氧化镁负载的盐酸羟胺和碳酸钠的混合物中加入腈类化合物,研磨成均匀固体后。将反应混合物在180 W的微波下照射3分钟。然后加入酰氯化合物后振摇5分钟,在600 W的微波下照射2到5分钟。经后处理可以以40%~70%的收率得到1,2,4-恶二唑(图5,Scheme a)。由于其产率低在2010年Rostamizadeh等人 [23],将腈类化合物,盐酸羟胺,氟化钾混合,研磨5分钟后将混合物在微波辐射下于100℃辐射5分钟。然后将酰氯化合物加入到混合物中,振摇5分钟,在130℃下于450 W再次照射10分钟可得1,2,4-恶二唑,收率在89%~95%之间(图5,Scheme b)。
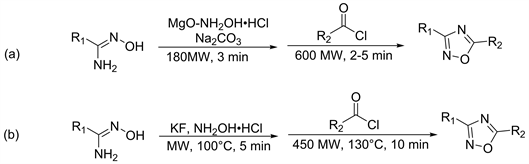
Figure 5. Dehydration and ring closure using amide oxime and acid chloride by microwave method
图5. 用微波法使酰胺肟和酰氯脱水合环
2.3. 酰胺肟和酸酐的合成
水是一种廉价且环保的溶剂,使用水为溶剂可以有效地提高反应的应用。因此Kaboudin等人 [24] 在2011年使用水为溶剂回流下使用酸酐和酰胺肟为原料合成1,2,4-恶二唑,收率为35%~92% (图6)。且酸酐和酰胺肟无论是芳香族还是脂肪族均可适用于反应,应用范围广。
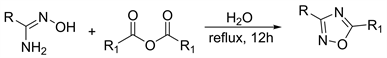
Figure 6. Use water as a solvent to dehydrate and combine amide oxime and acid anhydride
图6. 用水为溶剂使酰胺肟和酸酐脱水合环
2.4. 酰胺肟和脂类的合成
在2017年Baykov等人 [25],向酰胺肟和酯类的DMSO溶液中快速加入NaOH粉末。将反应混合物在室温下搅拌4小时。反应混合物加入冷水稀释。滤出所得沉淀物,用水洗涤。就可得到1,2,4-恶二唑化合物。此反应时间短、条件温和并且后处理简便,但是在有强供电子基团的芳族酯搅拌24小时后未反应,并且带有较弱的给电子取代基需要反应时间延长至16小时同时收率不会下降(图7)。
2.5. 酰胺肟和原羧酸的合成
Al3+-K10粘土等金属交换粘土有这可重复使用的,无毒,廉价的特点。故在2014年Suresh等人 [26],将酰胺肟和原羧酸在Al3+-K10粘土上,微波55℃下保持15分钟可以以91%~94%产率得到1,2,4-恶二唑化合物。此反应一锅无溶剂地合成目标产物大大减少了反应对于环境的污染,且催化剂可重复利用(图8)。
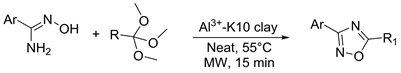
Figure 8. Amide oxime and ortho carboxylic acid ring
图8. 酰胺肟和原羧酸合环
3. 氰基和氧化氰的[3+2]环化加成
3.1. 氰基和醛肟生成1,2,4-恶二唑
近年来,有机高价碘化合物已成为环境友好,有效的试剂,可用于各种合成上有用的氧化转化反应,2-碘代苯甲酸就是之一。2015年和2016年Yoshimura课题组发表两篇文章 [27] [28] 发现可以使用2-碘代苯甲酸氧化醛肟得到1,2,4-恶二唑。在三氟甲磺酸存在室温下,用催化计量的2-碘代苯甲酸和化学计量的CPBA处理醛肟化合物,腈类化合物直接作为溶剂24小时,收率在62%~84%。这种氧化方法产率稳定,同时与常见的高价碘试剂相比,2-碘代苯甲酸可以从反应混合物中高效回收并循环使用。通过简单的酸碱液–液两相方案,可以轻松地从反应混合物中以97%的产率回收2-碘苯甲酸,以达到绿色经济的目的(图9)。
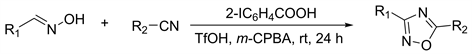
Figure 9. Iodide-catalyzed [3+2] cycloaddition
图9. 碘化物催化[3+2]环化加成
此类反应的机理经过多个反应研究发现,反应过程中可以检测到氧化氰中间体,故此方案为较为认可的反应机理:为把酮肟加入氧化剂或者加热脱氢转化为氧化氰中间体,随后氧化氰和氰基化合物进行[3+2]环化加成,可得目标化合物(图10)。

Figure 10. [3+2] Cyclization Addition Reaction Mechanism of 1,2,4-oxadiazole Compounds
图10. 1,2,4-恶二唑化合物的[3+2]环化加成反应机理
3.2. 亚硝酸甲硅烷基酯合成1,2,4-恶二唑
2017年Nikodemiak等人 [29],在研究亚硝酸甲硅烷基酯与苯乙醛和Yb(OTf)3在乙腈中的反应虽然目标产物收率低,出乎意料的分离出副产品1,2,4-恶二唑。1,2,4-恶二唑是由亚硝酸甲硅烷基酯与溶剂乙腈反应生成的。这一现象使作者将注意力转移到这种副反应上,并将其发展为一种新颖的1,2,4-恶二唑合成方法。向氰基化合物和AgOTf的氯苯溶液中分批加入亚硝酸甲硅烷基酯。在100℃下搅拌1小时,可得到得到1,2,4-恶二唑产物收率在25%~83%。这种方法底物范围广,反应速率高。但是亚硝酸甲硅烷基酯不稳定,不可长时间放置需低温保存或现用现制。作者根据酮肟和氰基化合物的反应机理,猜测机理如下:是将亚硝酸甲硅烷基酯消除得到氧化氰中间体,并且随后银离子催化[3+2]环化加成反应(图11)。
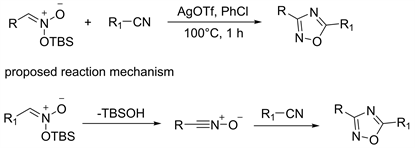
Figure 11. Synthesis and reaction mechanism of 1,2,4-oxadiazole from silyl nitrite
图11. 亚硝酸甲硅烷基酯合成1,2,4-恶二唑及其反应机理
3.3. 氰基与醛类的合成
2012年Vale等人 [30],使用催化剂Yb(NO3)3,同时优化了投料顺序,先将酮类化合物、Yb(NO3)3和HNO3搅拌十分钟,后加入氰基化合物,混合均匀后在80℃反应,收率在50%~87%。反应时间缩短到1~5小时。因为在后续的研究中检测出了α-硝基酮中间体。较为公认的反应机理为:酮烯醇化时被硝化得到α-硝基酮中间体,通过对α-硝基酮催化脱水而形成腈氧化物,并通过和腈类化合物[3+2]环化合成得到酰基-1,2,4-恶二唑衍生物(图12)。
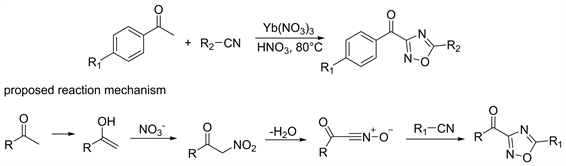
Figure 12. Synthesis and reaction mechanism of 1,2,4-oxadiazole from cyanos and aldehydes
图12. 氰基与醛类合成1,2,4-恶二唑及其反应机理
4. 以席夫碱为中间体的合成
Tka等人 [31] 在2010年,将手性酰胺肟和醛溶于甲苯中,后加入催化量的对甲苯磺酸,回流3~4小时,就可以得到1,2,4-恶二唑。产率在50%~93%。反应时可以保持反应底物的手型结构,且同时适用于脂族和芳族醛(图13)。
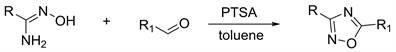
Figure 13. Synthesis of 1,2,4-oxadiazole under acidic conditions using Schiff base as intermediate
图13. 酸性条件下以席夫碱为中间体合成1,2,4-恶二唑
当使用醛和酰胺肟作为底物来制备1,2,4-恶二唑时,通常需要使用氧化剂而且反应在酸性条件,不耐酸底物不适用。因为作为底物的醛是弱氧化剂,所以在2016年Wang等人 [32],开发出来在碱性条件下以底物醛类化合物为氧化剂合成1,2,4-恶二唑的方法。将腈、盐酸羟胺和三乙胺溶于叔丁醇中,在80℃下搅拌18 h得到中间体酰胺肟。后将醛、Cs2CO3和DMSO加入到酰胺肟反应液进行混合,在N2保护下100℃再搅拌24小时。得到所需的1,2,4-恶二唑,产率在50%~93% (图14)。

Figure 14. Synthesis of 1,2,4-oxadiazole using Schiff base as an intermediate under alkaline conditions
图14. 碱性条件下以席夫碱为中间体合成1,2,4-恶二唑
较为认可的机理是,首先将酰胺肟和醛基化合物脱水形成席夫碱,然后环化为4,5-二氢-1,2,4-恶二唑化合物,随后连续氧化芳构化反应可得到1,2,4-恶二唑(图15)。
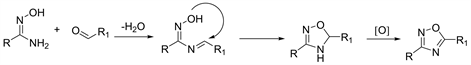
Figure 15. The reaction mechanism for the synthesis of 1,2,4-oxadiazole using Schiff base as an intermediate
图15. 以席夫碱为中间体合成1,2,4-恶二唑的反应机理
5. N-苄基酰胺肟为中间体的合成
N-苄基酰胺肟类似物通常需要原料自制,得到N-苄基酰胺肟类似物的制备方法一般为,在0℃下加入羧酰亚胺基氯化合物和苄胺在DMF中,然后加入三乙胺等有机碱并将混合物搅拌2小时。可得到N-苄基酰胺肟类似物,产率在60%~80%左右(图16)。
在2013年Zhang等人 [33],在DMF中加入K3PO4和N-苄基酰胺肟,在O2氛围下,在60℃加热,可得到1,2,4-恶二唑收率达53%~94% (图17,Scheme a)。在2016年Parker等人 [34],向反应瓶加入N-苄基酰胺肟和DDQ (2,3-二氯-5,6-二氰对苯醌)的DMF溶液中,并用氮气保护将混合物在150℃下搅拌30分钟可得到1,2,4-恶二唑(图17,Scheme b)。这两种方法类似均是使用氧化剂(O2或DDQ)将N-苄基酰胺肟氧化为席夫碱中间体,进而环化为4,5-二氢-1,2,4-恶二唑化合物,随后连续氧化芳构化反应可得到1,2,4-恶二唑(图17)。
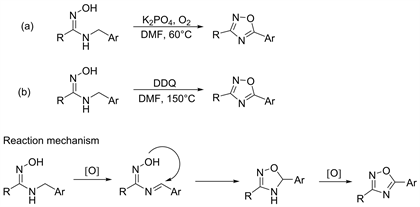
Figure 17. Synthesis and reaction mechanism of 1,2,4-oxadiazole by oxidation of N-benzyl amidoximes
图17. N-苄基酰胺肟氧化合成1,2,4-恶二唑及其反应机理
在2017年Lade等人 [35],报道了通过室温下使用NBS (N-溴琥珀酰亚胺)和DBU (1,8-二氮杂二环十一碳-7-烯)或者使用I2和K2CO3合成1,2,4-恶二唑的方案。就是将N-苄基酰胺肟类似物的DCM溶液中加入NBS和DBU室温下搅拌1小时就可得到1,2,4-恶二唑。另一种方案是将N-苄基酰胺肟类似物的甲苯溶液中加入I2和K2CO3室温下搅拌4小时就可得到1,2,4-恶二唑。产率均在50%~80%之间。此类可能在反应中是卤素化合物是通过在N-苄基酰胺肟的亚胺基团上发生卤代反应,随后在碱性条件下进行脱氢而形成中间体,继续环化为4,5-二氢-1,2,4-恶二唑化合物,随后连续氧化芳构化反应可得到1,2,4-恶二唑(图18)。

Figure 18. Synthesis and reaction mechanism of 1,2,4-oxadiazole catalyzed by N-benzyl amidoximes halide
图18. N-苄基酰胺肟卤化物催化合成1,2,4-恶二唑及其反应机理
6. 酰胺肟和炔基醛(酮)的合成
在2014年Kivrak等人 [36],预测酰胺肟与炔醛(酮)的反应可通过缩合反应合成1,2,4-氧杂二氮杂卓,但实际上通过一锅法却直接合成了1,2,4-恶二唑。向相应的炔基醛(酮)在无水甲醇中的搅拌溶液中加入酰胺肟化合物,并将所得混合物加热回流2小时,可以得到中间产物。从中间体c合成1,2,4-恶二唑作者提供了两种合成方法:第一种在氩气下加入NaH到相应的中间产物的乙腈溶液中在室温下搅拌可得到1,2,4-恶二唑。第二种在氩气下加入KOH到相应的中间产物在二氧六环的溶液中100℃下搅拌可得到1,2,4-恶二唑。但是炔基醛(酮)和酰胺肟化合物使用第二种方法可以直接合成1,2,4-恶二唑。产率在48%~80%之间(图19)。
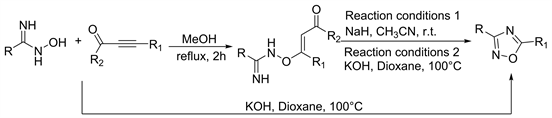
Figure 19. Synthesis and reaction mechanism of 1,2,4-oxadiazole from amide oxime and alkynyl aldehyde (ketone)
图19. 酰胺肟和炔基醛(酮)合成1,2,4-恶二唑及其反应机理
7. 氰基和炔烃合成1,2,4-恶二唑
以前没有报道从容易获得的炔烃直接构建1,2,4-恶二唑骨架,同时在硝酸离子氧化炔烃已经证明可以转化为α-硝基酮中间体。在2020年Bian等人 [37],将腈类化合物,Fe(NO3)3∙9H2O,t-BuCN和硝基苯混合,在氮气保护100℃下将炔烃化合物在硝基苯的溶液缓慢滴加反应中。反应混合物再搅拌24小时。反应完成后,经后处理可得酰基-1,2,4-恶二唑,产率在48%~80%。此反应机理是炔烃硝化氧化后得到α-硝基酮中间体,通过对α-硝基酮催化脱水而形成氧化腈中间体,并通过和腈类化合物[3+2]环化合成得到酰基-1,2,4-恶二唑衍生物(图20)。
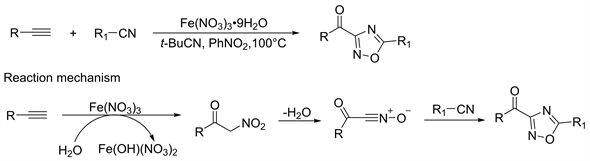
Figure 20. Synthesis and reaction mechanism of 1,2,4-oxadiazole from cyanos and alkynes
图20. 氰基和炔烃合成1,2,4-恶二唑及其反应机理
8. 总结与展望
由于3,5-取代-1,2,4-恶二唑化合物拥有广泛的生物活性,及其重要的应用价值,该类化合物的合成研究已取得长足的发展。本文归纳总结该类化合物的主要合成方法,尽管各有利弊,但近些年,随着3,5-取代-1,2,4-恶二唑化合物应用研究的发展的不断推进,极大地促进了3,5-取代-1,2,4-恶二唑化合物的合成研究。但研究出一种具有原料廉价易得、反应原子利用率高、反应条件温和、操作简单、后处理简便、收率良好等诸多优点的合成方法,将是今后研究工作者继续努力的方向。
基金项目
本文为江苏省自然科学基金BK20190608资助。