1. 引言
结肠癌是世界上常见的恶性肿瘤之一,其发生率较高,死亡率约为9.2% [1]。
羊肚菌(Morchella esculenta L.)是一种珍希的食用菌,属盘菌目、羊肚菌科、羊肚菌属,分布在我国的河南、陕西、甘肃、青海、西藏、新疆、四川、山西、吉林等地区 [2]。研究表明,羊肚菌多糖能够提高机体免疫力 [3],诱导HepG2 [4]、HT-29 [5] 等肿瘤细胞凋亡。
目前国内相关研究多以HT-29 [5] 细胞系为研究对象,对SW620细胞的研究尚未见报道。本文以人结肠癌细胞SW620为实验材料,证实了羊肚菌多糖能够抑制结肠癌细胞的体外增殖、迁移、细胞集落形成,诱导结肠癌细胞的凋亡和相关凋亡蛋白的表达,为进一步研究羊肚菌多糖的抗肿瘤作用提供理论依据。
2. 材料与方法
2.1. 实验材料
2.1.1. 主要试剂
羊肚菌多糖(长春理工大学王一东老师惠赠) [6],人结肠癌细胞SW620 (上海复祥),结晶紫染液(上海碧云天),细胞凋亡检测试剂盒(上海碧云天),四甲基偶氮唑蓝粉末(Geniview),胎牛血清(Sigma),L15培养基(Sigma),细胞培养板(Corning),鼠抗人caspase-3、Bax、Bcl-2、β-actin单克隆抗体(上海碧云天),羊抗鼠辣根过氧化物酶标二抗(Sigma)。
2.1.2. 主要仪器
全自动酶标仪(Thermo Multiskan Ascent)、流式细胞仪(Beckman Coulter)。
2.2. 实验方法
2.2.1. 细胞增殖抑制分析(MTT法)
取对数生长期细胞,稀释细胞浓度为5 × 104/ml,以每孔100 µl接种于96孔培养板,在37℃、5%二氧化碳、饱和湿度条件下培养6 h;实验设空白试剂组(只含培养基)、对照组和实验组。细胞贴壁后,实验组加入终浓度分别为400 mg/mL、600 mg/mL、800 mg/mL、1000 mg/mL、1200 mg/mL、1400 mg/mL、1600 mg/mL的羊肚菌多糖溶液,对照组加入不含羊肚菌多糖的培养液。分别培养24 h和48 h后,每孔加入MTT 10 mL,终浓度为500 µg/mL,重新放入培养箱中继续培养4小时后终止培养;吸弃培养液,每孔加入DMSO溶液150 mL,置于37℃空气浴振荡器中,水平轻微振荡2 min,使结晶物完全溶解;在酶联免疫检测仪(570 nm波长处)上测定各孔光吸收度OD值。记录实验结果并按下列公式计算:细胞存活率(%) = (A570实验 − A570空白)/(A570对照 − A570空白) × 100。实验组每个浓度梯度设3个复孔。
2.2.2. 细胞迁移分析
取稀释至浓度为1 × 104的对数生长期的细胞接种于6孔板上。待细胞生长至90%融合时,去除完全培养基,PBS清洗,用无血清培养基同步化培养12 h。然后沿板孔直径划一条直线,用PBS轻柔洗细胞3次,去除划下的细胞,加入无血清培养基。同时加入羊肚菌多糖(终浓度为1000 mg/mL和1200 mg/mL),设立空白对照,每组设三个复孔。放到37℃、5% CO2培养箱中培养继续培养24 h。
2.2.3. 集落形成分析
取对数生长期的细胞,以每孔300个活细胞接种于6孔板,37℃、5%二氧化碳、饱和湿度条件下培养6 h;实验组分别加入终浓度为1000 mg/mL,1200 mg/mL的羊肚菌多糖培养溶液,对照组加入等量正常培养液,继续培养24 h;去掉培养液后,再在不含羊肚菌多糖的完全培养液中培养10天。细胞集落用PBS洗涤2次,并在室温下在4%多聚甲醛中固定10 min,再用PBS洗涤2次,随后用结晶紫染色;观察实验结果,并与未经处理的细胞进行比较。
2.2.4. 细胞凋亡分析
取对数生长期细胞,稀释细胞浓度为1.0 × 105 /mL,接种于6孔培养板,每孔2 ml,在37℃、5%二氧化碳、饱和湿度条件下培养6 h;实验组分别加入终浓度分别为1000 mg/mL和1200 mg/mL的羊肚菌多糖培养溶液,设三组重复,对照组加入等量的全培养液,培养24 h;将细胞培养液吸出置于10mL离心管内,加入适量胰蛋白酶细胞消化液,室温孵育3分钟后,加入原先吸出的细胞培养液,轻轻吹打使贴壁细胞吹打下来时,转移至离心管内,1000转/min离心5 min,弃上清,收集细胞;用PBS轻轻重悬细胞并计数;取10万重悬细胞,1000转/min离心5 min,弃上清,加入195 mL Annexin V-FITC结合液轻轻重悬细胞,分别加入2.5 mL Annexin V-FITC和2.5 mL PI (碘化丙啶)混匀液,室温下避光孵育10 min,立即进行流式细胞仪检测。
2.2.5. Western blotting分析
在4℃条件下,将培养的羊肚菌多糖处理组和对照组细胞在蛋白裂解液(含0.001 mol/L EDTA,0.002 mol/LPMSF,10 μg/mLaprotinin,10 μg/mLleupeptin)中裂解。12000转/min离心5 min,取上清,应用蛋白定量试剂盒表示的方法定量,用SDS-PAGE上样缓冲液调节蛋白浓度为5 μg/μL,在沸水中煮沸10 min。取10 μL蛋白样品在2%聚丙烯酰胺凝胶上电泳,转膜后(PVDF),将PVDF膜分别与β-actin单克隆抗体(1:500),兔抗小鼠caspase-3、Bax、Bcl-2单克隆抗体(1:1000)室温孵育1 h,用TBST缓冲液充分漂洗后,再分别加入辣根过氧化物酶标记的羊抗鼠二抗(1:5000),室温孵育1 h,TBST缓冲液充分漂洗后,加入ECL化学发光底物,在暗室中底片曝光。
3. 结果
3.1. 羊肚菌多糖抑制SW620细胞增殖
如图1所示,MTT分析结果表明羊肚菌多糖对SW620细胞具有抑制增殖的作用,并呈时间及剂量依赖性(图1)。与对照相比,实验组的细胞存活率显著降低(P < 0.05)。统计分析表明羊肚菌多糖处理24 h后的SW620细胞IC50值为1220 ± 50 μg/mL,处理48 h后的IC50值为968 ± 63 μg/mL。
3.2. 羊肚菌多糖抑制SW620细胞迁移
细胞迁移是癌细胞增殖能力的重要指标 [7]。因此,本实验考察了羊肚菌多糖对SW620迁移能力的影响。如图2(a)所示,羊肚菌多糖抑制了细胞的迁移。对照组的细胞向划线区域迁移明显,划线区域变窄,而实验

Figure 1. Morchella polysaccharide inhibits proliferation of SW620 cell
图1. 羊肚菌多糖抑制SW620细胞增殖的mtt分析
 (a)
(a)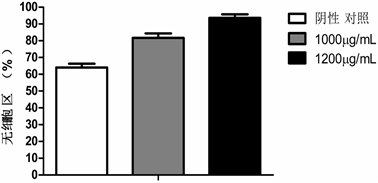 (b)注:图A为羊肚菌多糖对细胞迁移的影响,图B为无细胞区相对宽度的统计分析
(b)注:图A为羊肚菌多糖对细胞迁移的影响,图B为无细胞区相对宽度的统计分析
Figure 2. Morchella polysaccharide inhibits migration of SW620 cells
图2. 羊肚菌多糖抑制SW620细胞的迁移
组(1000 mg/mL, 1200 mg/mL)的细胞向划线区域迁移较少或不明显;如图2(b)所示,以0 h的划线区域的宽度为参照,将培养24 h后无细胞区宽度与之的比值进行统计分析,实验组与对照组相比差异显著(P < 0.05)。
3.3. 羊肚菌多糖抑制SW620细胞集落形成
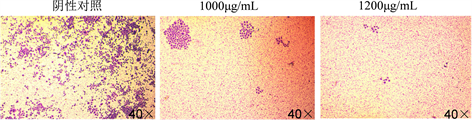
细胞集落形成也是癌细胞增殖的一项重要指标 [8]。如图3(a)所示,羊肚菌多糖对SW620细胞的集落形成具有抑制作用。对照组单个细胞集落形成能力较强,而实验组细胞则随羊肚菌多糖浓度增加集落形成能力减弱。药物浓度越高,单个细胞集落形成能力越弱且成剂量依赖;如图3(b)所示,将大于10个细胞的集落个数进行统计分析,实验组与对照组相比差异极显著(P < 0.01)。
 (a)
(a) (b)注:图A为羊肚菌多糖对细胞集落形成的影响,图B为细胞集落数量的统计分析
(b)注:图A为羊肚菌多糖对细胞集落形成的影响,图B为细胞集落数量的统计分析
Figure 3. Morchella polysaccharide inhibits colony formation of SW620 cells
图3. 羊肚菌多糖抑制SW620细胞集落形成
3.4. 羊肚菌多糖诱导SW620细胞凋亡
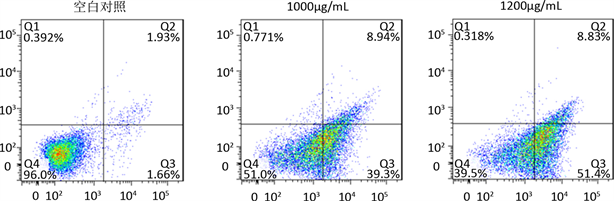
MTT的实验结果表明,羊肚菌多糖能够抑制SW620细胞的增殖,但抑制的途径是通过坏死还是凋亡需要通过实验验证。因此,用含1000 mg/mL,1200 mg/mL的羊肚菌多糖的培养液分别处理细胞24 h后,采用流式细胞仪检测分析。如图4(a)所示,羊肚菌多糖能够诱导细胞凋亡,且呈剂量依赖;如图4(b)所示,实验组与对照组相比差异显著(P < 0.05)。
 (a)
(a) (b)注:图A为流式细胞检测结果,图B为细胞凋亡统计分析
(b)注:图A为流式细胞检测结果,图B为细胞凋亡统计分析
Figure 4. Morchella polysaccharide induce SW620cell apoptosis
图4. 羊肚菌多糖诱导细胞凋亡
3.5. 羊肚菌多糖对凋亡相关蛋白的影响
主要的凋亡相关蛋白包括Bax、Bcl-2和Caspase-3。Western blot分析结果如图5所示,羊肚菌多糖能够诱导凋亡蛋白Bax和Caspase-3的表达量上调,诱导抗凋亡蛋白Bcl-2的表达量下调,并且呈剂量依赖性。
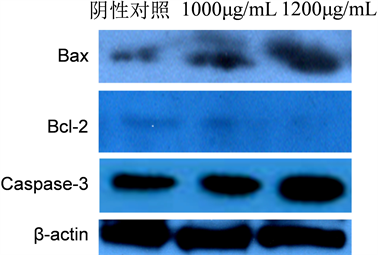
Figure 5. The effect of Morchella polysaccharide on the expression of major apoptosis regulatory proteins
图5. 凋亡相关蛋白的表达
4. 讨论
在我国,由于饮食结构的改变,结肠癌发病率和死亡率均处于较快速增长阶段。目前,临床治疗结肠癌的方法是手术切除后,再用放射疗法或用5氟尿嘧啶等化疗药治疗结肠癌,但毒副作用较大,易引起患者强烈的不适 [9]。
早先的研究发现,从很多植物或微生物中提取的多糖具有抑制癌细胞增殖的药理活性且毒副作用较小 [4] [5] [10]。这些研究为寻找抗肿瘤活性强、毒副作用小,提高患者的生活质量的天然药物提供了一个新的研究方向。
细胞凋亡分内源和外源两种途径。在内源性途径中,线粒体膜在药物的作用下裂解,释放出细胞色素C (Cytochromes C)和凋亡诱导因子(AIF)。细胞色素C与凋亡蛋白酶活化因子-1(Apaf-1)相互作用激活caspase 9,而活化的caspase 9启动caspase 3的活化,从而启动细胞凋亡 [11]。该过程受到Bcl-2蛋白家族中的促凋亡蛋白成员bax和抗凋亡蛋白成员Bcl-2的调节 [12]。
本研究的数据证明了羊肚菌多糖能够抑制结肠癌细胞SW620的增殖、迁移和细胞集落的形成,诱导癌细胞凋亡。通过凋亡相关蛋白的表达分析显示,促凋亡蛋白Bax和Caspase-3表达上升,而抗凋亡蛋白Bcl-2的表达下降。图1的结果表明羊肚菌多糖对结肠癌细胞SW620的增殖抑制呈现剂量和时间依赖,其24 h和48hIC50值分别为1220 ± 50 μg/mL和968 ± 63 μg/mL,略高于崔丽华 [4] 以HepG2为研究对象和刘超 [5] 以HT-29为研究的实验结果,这可能是所采用的癌细胞系不同所致。图2和图3的结果表明羊肚菌多糖能够抑制SW620细胞的迁移和集落形成能力,该实验结果未见有关报道。图4的结果表明羊肚菌多糖通过细胞凋亡的方式抑制了SW620细胞的增殖,该结果与刘超 [5] 和陈义勇 [10] 的研究相符。图5的结果表明羊肚菌多糖能够诱导促凋亡蛋白Bax和Caspase-3表达量上升、抗凋亡蛋白Bcl-2的表达量下降,该结果与之前的相关研究结果相符 [4] [9] [10]。由于上述三种凋亡相关蛋白是内源性途径即线粒体途径的主要发动蛋白,说明羊肚菌多糖通过线粒体途径诱导结肠癌细胞SW620的凋亡。
综上所述,羊肚菌多糖通过细胞凋亡的方式抑制了结肠癌细胞SW620的增殖,并且抑制了SW620细胞的迁移和增殖。本研究结果为进一步研究和开发羊肚菌多糖提供了新的实验依据,为结肠癌的临床治疗提供了新的参考途径。
基金项目
吉林省大学生创新创业训练计划项目(20201018)。