1. 引言
邻硝基苯甲醛是重要的精细化工与有机中间体,在农药、医药 [1] [2]、有机合成 [3]、染料和材料 [4] 等行业有着广泛的应用,是合成治疗心脑血管疾病药物硝基吡啶 [5]、硝苯地平 [6] 和拉帕替尼 [7] 等的关键中间体。虽然邻硝基苯甲醛的合成方法有很多 [8] [9] [10],但都存在一些缺点和明显不足,如:转化率低、选择性不高、过程繁琐、污染环境和生产成本高等,随着邻硝基苯甲醛的市场需求量逐年增加,现有的合成工艺及生产方法已不能满足工业化生产的需要。
传统的邻硝基苯甲醛的生产方法是以邻硝基甲苯为原料经硝化、氧化而制得。Vetelino [8] 等将邻硝基甲苯溶于DMF和DMFDMA中,得中间体N,N’-二甲基-2-(2-硝基苯基)乙烯胺。将N,N’-二甲基-2-(2-硝基苯基)乙烯胺和NaIO4在室温下溶于50%的四氢呋喃中反应制备邻硝基苯甲醛,经后处理得到的邻硝基苯甲醛收率为80%。此方法原料易得,操作简单,仅需要两步反应,但所用氧化剂为高碘酸钠,其成本较高,且对反应生成的碘酸钠处理繁琐,易对环境造成污染,使用此生产方法要面对很大的生态环保压力。
Tajbakhsh [11] 等以邻硝基苯甲醇为原料制备邻硝基苯甲醛,反应条件温和,反应速率较快,但所用到的过氧化物原料的制备比较繁琐,且产生的三废较多,严重制约了工业化生产。岳可芬 [12] 等提出以邻硝基苯甲酸为原料,合成邻硝基苯甲醛,该方法用到的金属钠丝较为活泼,遇水会产生大量热量易导致自燃甚至爆炸,同时乙二胺具有较强腐蚀性和较强刺激性,使工业化生产存在较大的安全隐患,且产品的收率也相对较低,不具备工业化生产的价值。李彤等 [13] 报道了以邻硝基甲苯为起始原料,制备邻硝基苯甲醛,所采用的原料邻硝基甲苯价格低廉,在工业化生产上有利于节约成本,但该方法用到的甲基磺酸铈的制备较为复杂,难以满足工业化生产的规模,并且反应处理时会用到大量刺激性、易燃易爆的甲苯,在实际生产上存在不确定或不可预测的安全问题。
本文在现有工艺的基础上,采用邻硝基甲苯与N,N’-二甲基甲酰胺二甲基缩醛经两步反应合成邻硝基苯甲醛,此工艺转化率高、成本低、操作简单、反应条件温和、对环境污染小,是符合工业生产需要且有益于生态环境保护的新工艺。
2. 实验部分
2.1. 主要仪器和试剂
仪器:Bruker AVANCE 400MHz核磁共振波谱仪,尼高力Nicolet6700傅立叶红外光谱仪,岛津UV3600紫外/可见/近红外分光光谱仪,岛津UFLC-2010 PLUS高效液相色谱仪。
试剂:乙酸乙酯、石油醚均为分析纯,购于南京化学试剂公司,过氧化氢(30%)、N,N’-二甲基甲酰胺(DMF)购于国药集团化学试剂有限公司,液体甲醇钠(30%)、邻硝基甲苯(99%)购于上海麦克林生化科技有限公司,硫酸二甲酯(99%)购于萨恩化学技术(上海)有限公司。
2.2. 实验方法
2.2.1. N,N’-二甲基甲酰胺二甲基缩醛的合成

Figure 1. Synthesis reaction diagram of DMFDMA
图1. N,N’-二甲基甲酰胺二甲基缩醛的合成反应示意图
N,N’-二甲基甲酰胺二甲基缩醛(DMFDMA)的合成路线如图1所示。首先称取10.96 g N,N’-二甲基甲酰胺(0.15 mol)加入到50 mL的圆底烧瓶中,加热搅拌,控制温度在65℃左右,在1小时内将18.9 g硫酸二甲酯(0.15 mol)逐滴加入到上述溶液中,滴加完毕后控制温度在75℃左右反应3~4小时,得到亚胺络合物,待反应装置冷却后置于冰盐水浴中,使温度控制在0℃以下,待用。
将32.41 g甲醇钠(0.18 mol)的甲醇溶液加入圆底烧瓶中,常压蒸馏除去甲醇溶液,再加入约30 mL石油醚,剧烈搅拌使甲醇钠分散在其中,通过冰盐水浴使反应温度控制在0℃以下,逐滴滴加上述亚胺络合物,控制滴加速率使得在2小时内滴加完成,滴加完毕后继续搅拌反应2~3小时,过滤并用10 mL石油醚洗涤3次,洗涤完成后合并石油醚洗液,除去滤液中的石油醚,并收集产物,获得N,N’-二甲基甲酰胺二甲基缩醛粗产品16.62 g,收率为93%。
2.2.2. 邻硝基苯甲醛的制备

Figure 2. Synthesis reaction diagram of 2-Nitrobenzaldehyde
图2. 邻硝基苯甲醛的合成反应示意图
邻硝基苯甲醛的合成反应如图2所示,在50 mL的圆底烧瓶中加入2.74 g邻硝基甲苯(20 mmol)、7.14 g N,N’-二甲基甲酰胺二甲基缩醛(60 mol)和8 mL DMF,搅拌均匀,加热回流12小时后,再加入4.76 g N,N’-二甲基甲酰胺二甲基缩醛(40 mmol),继续加热回流10小时,期间用TLC点板中控(展开剂为石油醚/乙酸乙酯(v/v) = 4/1),直到化合物邻硝基甲苯最大限度转化为化合物N,N’-二甲基-2-(2-硝基苯基)乙烯胺,反应完毕后,常压蒸馏回收N,N’-二甲基甲酰胺二甲基缩醛、减压蒸馏回收DMF,将剩余液体冷却至室温,得到中间体N,N’-二甲基-2-(2-硝基苯基)乙烯胺2.8 g,收率为93%。
将1 g中间体N,N’-二甲基-2-(2-硝基苯基)乙烯胺(5.2 mmol)溶于甲醇中,冰浴冷却至0℃以下,边搅拌边滴加2.18 g 27.5%的过氧化氢(17.68 mmol),控制滴加速率在1小时内滴加完成,滴加完毕后再继续搅拌1小时,移去冰浴,在25℃~30℃下反应至红色褪去,TLC跟踪反应(展开剂:石油醚/乙酸乙酯(v/v) = 4/1),反应完毕后,在体系中加入10 mL蒸馏水,用10 mL乙酸乙酯萃取反应液3次,并使用无水硫酸钠干燥有机相,过滤,将滤液通过旋转蒸发除去,得到淡黄色油状液体,在5℃下放置3~4小时,析出淡黄色针状结晶邻硝基苯甲醛0.69 g,收率为88.03%。
3. 结果与讨论
3.1. N,N’-二甲基甲酰胺二甲基缩醛分析
3.1.1. N,N’-二甲基甲酰胺二甲基缩醛的反应机理
在N上孤对电子的作用下,DMF的甲酰基氧亲核进攻硫酸二甲酯中的甲基,发生甲基化反应形成亚胺络合物 [14],加入甲醇钠后,甲醇钠中的甲氧基负离子亲核进攻亚胺离子,从而最终得到N,N’-二甲基甲酰胺二甲基缩醛。
3.1.2. 1H NMR分析
N,N’-二甲基甲酰胺二甲基缩醛1H NMR如图3所示,从图中可以看到在δ = 4.29 ppm处的峰为连接两个缩醛的碳上的氢,在δ = 3.26 ppm处的峰为两个缩醛上的六个氢,在δ = 2.21 ppm处的峰为与两个甲基上的六个氢。
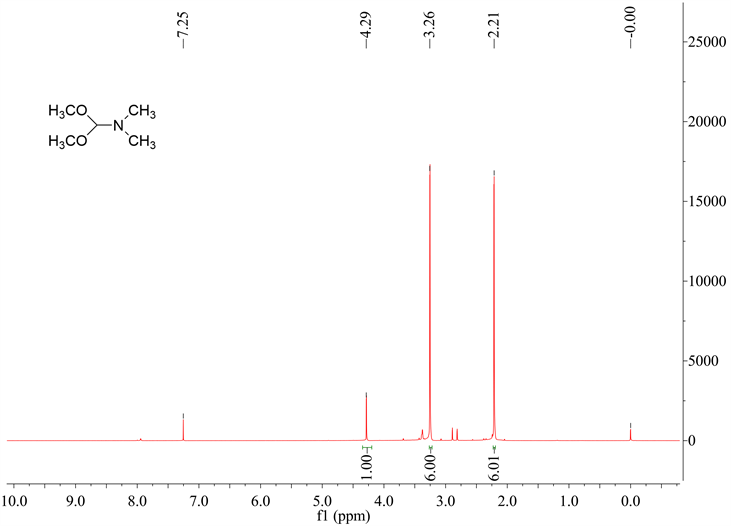
Figure 3. The 1H NMR spectra of DMFDMA
图3. N,N’-二甲基甲酰胺二甲基缩醛的1H NMR谱图
3.1.3. 红外分析 [15]
N,N’-二甲基甲酰胺二甲基缩醛的FT-IR谱图如图4所示,从图中可以看到2928 cm−1处的吸收峰为甲基的C−H伸缩振动峰,1666 cm−1处的强吸收峰为叔胺的伸缩振动峰,1390 cm−1处的吸收峰为甲基的C−H弯曲振动峰,1095 cm−1处的吸收峰为C−O−C的不对称伸缩振动峰。

Figure 4. FT-IR spectra of DMFDMA
图4. N, N-二甲基甲酰胺二甲基缩醛FT-IR谱图
3.2. 邻硝基苯甲醛分析
3.2.1. 邻硝基苯甲醛的反应机理
首先DMFDMA的甲氧基负离子离去,产生了一个活性更强的中间体;然后,甲氧基负离子进攻邻硝基甲苯的甲基氢,使邻硝基甲苯甲基氢去质子化形成碳负离子,从而进一步进攻上述中强活性的中间体,失去一分子甲醇,得到N,N’-二甲基-2-(2-硝基苯基)乙烯胺。N,N'-二甲基-2-(2-硝基苯基)乙烯胺在过氧化氢的作用下先被氧化形成环氧化合物,然后在弱酸性的条件下水解生成邻二醇化合物,邻二醇化合物在过氧化氢的作用下,连接羟基的两个碳原子间的键断裂,从而生成了邻硝基苯甲醛和DMF。
3.2.2. 1H NMR谱图
邻硝基苯甲醛的1H NMR如图5所示,从图中可以看到与醛基相连苯环上的碳原子为第1位,与硝基相连的碳原子为第2位,δ = 8.12~7.95 ppm处的峰为苯环上第3位和第6位碳原子上的氢,由于羰基和硝基吸电子基团对其影响,使得化学位移向低场移动,δ = 7.83~7.75 ppm处的峰为苯环上第4位和第5位碳原子上的氢,δ = 10.44 ppm 处的峰为醛基上的氢。

Figure 5. The 1H NMR spectra of 2-Nnitrobenzaldehyde
图5. 邻硝基苯甲醛1H NMR谱图
3.2.3. 13C NMR谱图
邻硝基苯甲醛的13C NMR如图6所示,从图中可以看到苯环上与醛基相连的碳原子为第1位,与硝基相连的碳原子为第2位,δ = 188.26 ppm出现的峰为邻硝基苯甲醛中醛基中C的特征吸收峰,δ = 149.66 ppm出现的峰为邻硝基苯甲醛的苯环上与硝基相连的C的特征吸收峰,δ = 134.19ppm和δ = 133.83 ppm出现的峰为邻硝基苯甲醛苯环上第4位和第5位C的特征吸收峰,δ = 131.42 ppm出现的峰为邻硝基苯甲醛苯环上第1位C的特征吸收峰,δ = 129.72 ppm出现的峰为邻硝基苯甲醛苯环上第6位C的特征吸收峰,δ = 124.58 ppm出现的峰为邻硝基苯甲醛苯环上第3位C的特征吸收峰。
3.2.4. 红外谱图分析
邻硝基苯甲醛的FT-IR谱图如图7所示,从图中可以看到3095 cm−1处出现的吸收峰为芳基C−H伸缩振动峰,2851 cm−1处出现的吸收峰为醛基的C−H伸缩振动峰,1698 cm−1处出现的强吸收峰为醛基的C=O伸缩振动峰,1607~1569 cm−1处的吸收峰为芳环骨架的C=C伸缩振动,1525 cm−1处的吸收峰为硝基的伸缩振动峰,1338 cm−1处的吸收峰为苯环的C−H面内弯曲振动,1188 cm−1处的吸收峰为苯环C与硝基N的C−N伸缩振动,在738 cm−1的吸收峰表现了邻二元取代的特征。
4. 结论
首先以N,N’-二甲基甲酰胺(DMF)为原料,合成N,N’-二甲基甲酰胺二甲基缩醛,蒸馏除去甲醇钠中的甲醇能够提高产物的收率,以石油醚作溶剂避免了反应过程中副反应的发生,易实现产物的纯化与分离,提高了产物的纯度和产率。在合成邻硝基苯甲醛过程中,采用的原料邻硝基甲苯价格低廉,相较于

Figure 6. The 13C-NMR spectra of 2-Nnitrobenzaldehyde
图6. 邻硝基苯甲醛13C NMR谱图

Figure 7. FT-IR spectra of 2-Nnitrobenzaldehyde
图7. 邻硝基苯甲醛FT-IR谱图
其他工艺能更好的节约成本;以过氧化氢为氧化剂,对环境基本无污染,符合目前对生态环境保护的要求。此外,工业上可尝试用臭氧低温选择性氧化工艺,一方面提高反应的收率与纯度,另一方面使后期氢化反应在无水介质下进行,所有溶剂可循环套用,是绿色环境友好的工艺。目前本工艺总收率可达88.03%,纯度可达99.07% (用HPLC检测),操作简单,原料便宜易得,所用的溶剂均可回收二次利用,提高了生产工艺的经济效益,且不会产生难处理的废水、废气、废固,有利于环境化生产及生态环境的保护,符合目前可持续发展的要求。